1. PHẢN ỨNG CÓ HẠI CỦA THUỐC (ADR):
A. Tổng kết công tác báo cáo ADR:
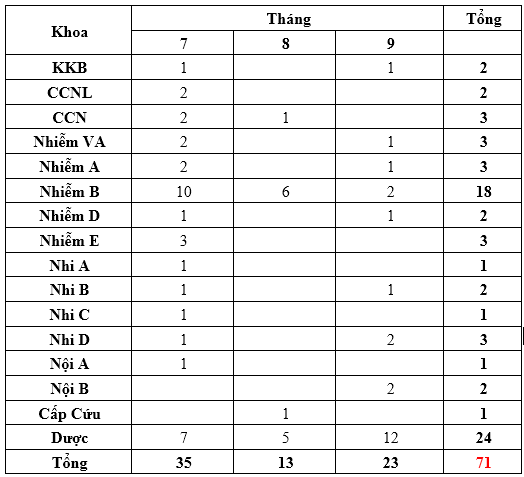
Quý 3 – 2024 ghi nhận có 71 báo cáo ADR xảy ra tại 16 khoa (theo bảng). Khoa dược báo cáo nhiều nhất với 24 ca, tiếp sau đó là khoa nhiễm B với 18 ca. Số lượng và số khoa báo cáo ADR trong quý 3 tăng cao hơn so với 2 quý đầu năm nay.
Trong đó phần lớn là các ADR không nghiêm trọng trên da niêm, tuy nhiên có một số báo cáo nổi bật trong quý vừa qua: sốt do Vancomycin, sốt do Piperacillin/Tazobactam, các ADR trên thần kinh trung ương của Imipenem như mất ngủ, ảo giác, rung giật cơ.
Các khoa lâm sàng tiếp tục tăng cường giám sát, theo dõi, xử trí và báo cáo tác dụng phụ không mong muốn của thuốc gửi về khoa Dược trên phần mềm Ehospital.
B. Phản hồi các khoa lâm sàng về chất lượng thuốc:
Trong tháng 7, Khoa Dược ghi nhận 01 phản hồi từ khoa lâm sàng về chất lượng cảm quan của dung dịch tiêm truyền tĩnh mạch Midazolam ngả vàng trong khi đang truyền. Khoa Dược tiến hành đổi trả, cấp phát mới để kịp thời điều trị người bệnh. Đồng thời, DLS hỗ trợ rà soát việc sử dụng và chất lượng trong khi truyền của chế phẩm Midazolam cùng NSX, số lô, hạn dùng; Kho chẵn và kho lẻ kiểm tra lại điều kiện bảo quản và chất lượng cảm quan của chế phẩm Midazolam trên. Tính tới thời điểm hiện tại chưa ghi nhận phản hồi khác thêm về chất lượng Midazolam.
Khoa Dược cũng đồng thời ghi nhận liên tiếp 04 ca dị ứng với chế phẩm TAZOPELIN 4,5g (Piperacillin 4g + Tazobactam 0,5g) của cùng nhà sản xuất với số lô 24022 trong vòng 1 tuần, có 2 ca mức độ nghiêm trọng. Theo quy định của bệnh viện, để đảm bảo an toàn cho người bệnh, Khoa dược đề nghị công ty rà soát và xem xét đổi lô thuốc khác, tiếp tục theo dõi chặt chẽ ADR của chế phẩm này. Số lượng báo cáo ADR do Tazopelin xảy ra với tần suất giảm sau khi đổi lô thuốc khác với 05 ca báo cáo trong tháng 8 và 9.
2. THÔNG TIN THUỐC, CẢNH GIÁC DƯỢC:
Xin xem phần Thông tin thuốc
3. KHUYẾN CÁO DƯỢC LÂM SÀNG QUÝ 4-2023
3.1. Tổng kết công tác giám sát và can thiệp dược lâm sàng:
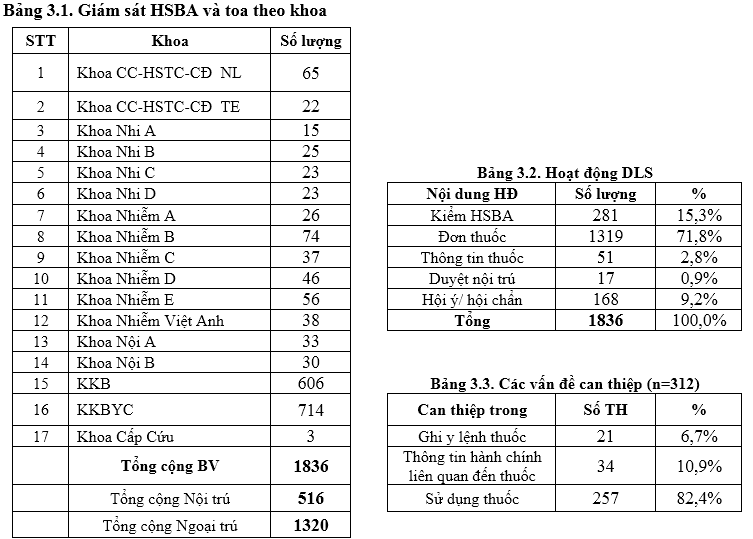
Công tác giám sát được thực hiện trên 516 TH nội trú (tăng nhẹ so với quý 3/2024 là 490) và 1.320 toa thuốc ngoại trú (tăng so với quý 2/2024 là 1.034) tăng cường công tác giám sát đơn ngoại trú tại KKBYC do số lượng giám sát giảm từ 1000 toa (quý 1/2024) còn 730 toa trong quý 2/2024 và hiện còn 714 toa trong quý 3/2024. Đơn vị dược lâm sàng thực hiện 312 can thiệp dược lâm sàng chiếm 17% trong các hoạt động thường quy (tăng so với Quý 2/2024 là 16%). Chủ yếu là các can thiệp hội ý/hội chẩn về thuốc: liều kháng sinh (TDM 07 ca voriconazol, 17 ca linezolid, 347 ca vancomycin, …), phối hợp/lựa chọn kháng sinh và tư vấn về nguy cơ tác dụng bất lợi của thuốc,…và can thiệp trực tiếp khi duyệt nội trú hàng ngày.
Trong 312 can thiệp có 82.4% là can thiệp trong việc sử dụng thuốc và tăng so với Quý 2/2024 (75%). Quý 3/2024, sự thống nhất ý kiến giữa dược lâm sàng và bác sĩ điều trị là 98,4% (giảm nhẹ so với quý 2/2024), trong đó có 01 trường hợp đồng ý một phần, 04 ca không đồng ý ở các khoa khám ngoại trú và NTBV chủ yếu về thời gian sử dụng corticoid cho chỉ định dị ứng da, viêm da cơ địa. Tuy nhiên, tỷ lệ can thiệp kịp thời khoảng 91%, tăng nhẹ so với quý 1/2024 (90%). Dược sĩ lâm sàng cần tăng cường can thiệp, sâu sát hơn khi duyệt y lệnh nội trú và đi khoa.
3.2. Kết quả tiêu chí giám sát hồ sơ bệnh án, đơn thuốc và can thiệp DLS:
Tiêu chí liều thuốc và y lệnh đầy đủ tăng nhẹ so với Quý 2/2024. Các khoa thuộc khối hồi sức – bệnh nặng và các khoa lâm sàng có lượt bệnh đông: Nhiễm E, Nhiễm D có tỷ lệ cần điều chỉnh về liều thuốc khá cao từ 20-30%, cần lưu ý về chức năng gan thận, bệnh nặng để điều chỉnh liều thích hợp và thực hiện các khuyến cáo về liều thuốc đã được cảnh báo; các khoa khối hồi sức khác có cải thiện tỷ lệ rõ rệt so với quý trước. Đồng thời, các bác sĩ/điều dưỡng khi nạp y lệnh trên HIS cần chú ý để tránh trùng hoặc sai y lệnh, sai ngày giờ dùng thuốc, ở KKB và KKBYC trong Quý 3-2024 lỗi đánh máy sai tên thuốc giảm so với Quý 2-2024
Toàn bệnh viện đạt 13 tiêu chí về sử dụng thuốc 96.9% (tăng nhẹ so với Quí 2/2024 là 95%).


3.3. Khuyến cáo dược lâm sàng:
Quy chế kê đơn:
Khi nạp y lệnh trùng trên hệ thống HIS hoặc đánh nhầm số lượng, tên thuốc, trùng y lệnh; đặc biệt lưu ý khi choàng cử thuốc. Các sai sót này chưa xảy ra và ngăn chặn kịp thời tuy nhiên vẫn lặp lại sai sót trong Quý 2/2024 và có giảm nhẹ so với quý trước. Khuyến cáo các khoa khám bệnh kiểm tra lại đơn thuốc. Trong nội trú, lưu ý thực hiện Phiếu KSHC có chữ ký của bác sĩ hội chẩn, ghi đầy đủ chẩn đoán điều trị.
Ví dụ:
• Sai hàm lượng: 08 trường hợp
• Sai số lượng: 07 trường hợp
• Sai tên thuốc: 09 trường hợp
-
Kê đơn EZVASTEN (atorvastatin 20mg+ ezetimid 10mg) NhậpEnzicoba (selen 50microgam+ crom 50microgam+ acid ascorbic 50mg)
-
Kê đơn Avonza Nhập Acriptega
-
Kê đơn FibYHE - 200 (Ibuprofen 200mg) Nhập FIBrofin - 145 (Fenofibrat 145mg)
-
Kê đơn BosTEKID 30mg (Fexofenadin 30mg) Nhập BosTOCEF 300mg (Cefdinir 300mg)
-
Kê đơn AntiCLOR (Dexchlorpheniramin 2mg/5ml) Nhập AMITRIPTYLIN 25mg
-
Kê đơn Ivermectin 6mg Nhập Praziquantel 600mg
-
Kê đơn Fluconazole 150mg Nhập Itraconazol 100mg
-
Kê đơn EZVASTEN (Atorvastatin 20mg+ ezetimide 10mg) Nhập Enzicoba
-
Kê đơn Atorvastatin 20mg Nhập Atorvastatin 20mg+Ezetimib 10mg
Liều:
Bệnh nhân nữ, 72t, 45 kg, 150 cm. Chẩn đoán: Viêm mô tế bào bàn chân P; Tổn thương thận cấp. CrCl ~ 23 ml/phút. Rx Linezolid 600 mg q12h *Vấn đề: Bệnh nhân lớn tuổi, CrCl < 30 mL/phút.
-> Khuyến cáo đo kiểm tra nồng độ đáy Linezolid. Kết quả đo Cmin sau 48h, Cmin = 13.496 ug/mL
-> Khuyến cáo giảm liều thành 600 mg q24h; Theo dõi PLT, lactate trong suốt quá trình điều trị với Linezolid
Bệnh nhân nhiễm Cryptococcus neoformans. đang điều trị Amphotret 19 ngày + Fluconazol 600 mg/24h, hiện kết quả dịch não tủy có cải thiện sinh hóa, tế bào, cấy âm lần 2, GGT tăng từ 61 168 245 U/L nghi do Fluconazol:
-> Hiện đang dùng Fluconazol 600 mg/ngày, đề nghị giảm còn 400 mg/ngày, theo dõi GGT mỗi 3 ngày.
-> Chẩn đoán: Viêm màng não nấm Cryptococcus neoforman đang điều trị giai đoạn củng cố - Xơ gan - Viêm gan siêu vi B mạn HBeAg âm - Viêm gan do thuốc - Hạ Kali máu - Hạ Magnesi máu. Hiện BN đang điều trị giai đoạn củng cố với Fluconazol 900mg/ngày, ghi nhận (1) tăng men gan AST/ ALT/ GGT: 35/ 53/ 382 U/L; (2) Kali huyết giảm (đã bù Kali 2.91 3.43 mmol/L) nghi do Fluconazol
-> Khuyến cáo giảm liều Fluconazol 600mg/ngày (2 viên Fluconazol 150mg x 2 lần/ngày). BN chuẩn bị xuất viện dặn dò BN tái khám, nếu có gì lạ trên tiêu hóa, tim mạch tái khám sớm ngay.
BN nam, 40t, 70kg, CrCl > 180 mL/phút. Chẩn đoán TD vêm phổi - suy hô hấp/Đái tháo đường - Tăng huyết áp đang Rx vancomycin 1.25g/8h Ctrough=8.6 mcg/ml AUC < 400 mcg.h/ml
-> Chuyển qua chế độ truyền liên tục 4g/24h, đo nồng độ Css vancomycin sau 18 tiếng kể từ lúc truyền liên tục. Kết quả Css = 23.7 ug/mL (AUC24h = Css x 24h) (Mục tiêu Css = 17 – 25 ug/mL).
-> Đề nghị tính liều Vancomycin ban đầu theo Clincalc.com, nhập trực tiếp CrCl (tính toán lại CrCl vs Ehos trên những đối tượng bệnh nhân đặc biệt: thừa cân - béo phì, nhẹ cân, ARC,…)
-> Cân nhắc CI-V trên đối tượng bệnh nhân ARC ngay từ đầu nhằm đạt mục tiêu AUC24h trong 24-48h tính từ khi khỏi trị
-> Lưu ý khi truyền CI-V vẫn phải đảm bảo nồng độ pha loãng Vancomycin (≤ 4 mg/mL) để giảm thiểu nguy cơ viêm tắc tĩnh mạch trong quá trình điều trị với Vancomycin (trừ trường hợp bệnh nhân cần hạn chế dịch)
BN rung nhĩ. Rx Xabantk (Rivaroxaban) 10mg x 1 lần/ngày
-> Chỉnh liều Xabantk 15mg x 1 lần/ngày
BN Uốn ván toàn thể giai đoạn toàn phát N12; Rối loạn thần kinh thực vật. Mạch quay rõ 115 lần/phút; Huyết áp còn dao động từ 110-140 mmHg, hiện 120/70 mmHg *Vấn đề: Rx Carvedilol 6.25 mg q24h
-> T½ Carvedilol ~ 7- 10h, khuyến cáo liều 3.125 mg q12h cho chỉ định nhịp nhanh
Bệnh nhân 70t, 56 kg, 165 cm. Chẩn đoán: Sốc nhiễm trùng do K. pneumoniae; ARDS. Cấy máu vị trí 2 (01/08): K. pneumoniae đa kháng, chỉ còn nhạy Fosfomycin. Đang điều trị với Ceftazidim/Avibactam. CrCl ~ 51 mL/phút *Vấn đề: Bác sĩ hội chẩn liều Fosfomycin cho nhiễm trùng nặng - đa kháng
-> 1) Khuyến cáo liều Fosfomycin 18g/ngày, chia q8h ~ 6g q8h
-> 2) Khuyến cáo pha thuốc trong dung môi Glucose 5% do thành phần thuốc Fosfomycin chứa hàm lượng cao muối Natri (1g ~ 14.4 mEq hay 10g ~ 1L normal saline)
-> 3) Theo dõi điện giải trong suốt quá trình điều trị
Bệnh nhân 74t, 57 kg, 145 cm. CHẨN ĐOÁN:- Viêm nội tâm mạc nhiễm trùng do P. aeruginosa;- Bệnh mạch vành đã đặt stent;- Nhồi máu não - xuất huyết tiểu não và thùy thái dương cũ;- Hẹp ĐM cảnh trong 2 bên;- Tăng huyết áp;- Phù bạch mạch chân (T). Rx Meropenem 1g q8h + Gentamicin ~ 4 mg/kg q24h (ODA). CrCl ~ 63 mL/phút
*Vấn đề: Hội chẩn Chuyên khoa Nội Tim mạch đề nghị Meropenem + Tobramycin. Bác sĩ hội chẩn DLS về liều và cách pha - dùng Tobramycin.
-> Khuyến cáo: 1) Meropenem 1g q8h + Tobramycin 1.5 - 2 mg/kg q8h (TDA) (1 lọ (80 mg/2mL) q8h) 2) Cách pha: Mỗi cử pha trong 50 -100 mL NaCl 0.9% truyền trong 60 phút
-> Hiện không TDM AG (Amikacin, Gentamicin, Tobramycin) Rx và hiệu chỉnh theo CrCl
Sử dụng thuốc:
Bệnh nhân nam 51t, 60 kg, 162 cm. Chẩn đoán: Viêm phổi - Nhiễm nấm huyết do Apiotrichum mycotoxinivorans (Trichosporon mycotoxinivorans); Bệnh não gan độ II-III; Nhiễm trùng huyết; Viêm phổi - ARDS; Tổn thương thận cấp; Rối loạn điện giải; Rx Amphotercin B phức hợp lipid liều 5 mg/kg/ngày + Voriconazol LD 6 mg/kg q12h, MD 4 mg/kg q12h (~ 200 q12h). *Vấn đề: Vi sinh khuyến cáo đổi sang Itraconazol do xét nghiệm kháng nấm đồ ghi nhận MIC của Intraconazol ổn định, MIC của Voriconazol gia tăng (vẫn còn nhạy); Suy thận đang CRRT, CrCl ~ 37 mL/phút; AST/ALT = 286/146 UI/L (giảm nhiều), Billirubin T.P/TT = 119/110 (tăng)
-> Ý kiến DLS: 1) Sinh khả dụng Voriconazol P.O > 90%, Itraconazol ~ 55%, bệnh nhân đang nằm ICU, SKD đường P.O không đảm bảo; 2) Hiện có thể theo dõi nồng độ Voriconazol trong máu để dự đoán hiệu quả của thuốc kháng nấm; 3) Phác đồ khuyến cáo: Ampholip + Voriconazole (Uptodate); 4) Lâm sàng ngày 19/07: Hiện không diễn tiến xấu hơn, giảm được liều vận mạch
-> Trao đổi 3 bên: Bác sĩ lâm sàng + Vi sinh lâm sàng + Dược lâm sàng quyết định giữ phác đồ kháng nấm: Ampholip + Voriconazole (TDM và hiệu chỉnh liều khi có kết quả đo); đồng thời theo dõi sự gia tăng MIC của Voriconazol và ADR của Voriconazol (CN gan) .
BN điều trị với Imipenem 3g/ngày (Melioidosis) x 18 ngày #5 ngày nay than mất ngủ, thấy nhiều người đứng quanh giường, nói chuyện bên tai Nghi ngờ ADR liên quan Imipenem/cilastatin (1). Khuyến cáo ngưng Imipenem/cilastatin Đổi Meropenem 1g/8h, tiếp tục theo dõi biểu hiện ADR BN không còn tình trạng mất ngủ, tuy nhiên bệnh nhân giảm bạch cầu hạt sau khi Rx Meropenem
-> (1) Rối loạn tâm thần như ảo giác, lú lẫn là ADR đã được ghi nhận có thể gặp khi sử dụng Imipenem/cilastatin (tần suất ít gặp) theo DTQG 2022; BN đang điều trị với Imipenem 3g/ngày (liều cho Melioidosis) x 18 ngày, cần tiếp tục kháng sinh theo phác đồ do đó đề nghị sử dụng Meropenem;
-> (2) Giảm bạch cầu hạt. Đây là ADR có thể gặp khi Rx Meropenem (tần suất ít gặp) theo DTQG 2022 . Kết quả CLS: WBC từ 7.99 1.43K/uL, Neu 0.18K/uL # 12.9%, Hgb 10.1g/dL, PLT 187K/uL, TQ 100%
-> Hội ý khoa nay ngưng kháng sinh, theo dõi lâm sàng (sốt+ ban da), kiểm tra lại procalcitonin để đánh giá lại đáp ứng kháng sinh và tình trạng nhiễm trùng.
BN nam, 25 tuổi, 55kg, 170cm. Chẩn đoán: Suy dinh dưỡng. *Vấn đề: BN cần sử dụng Smoflipid 20%, BS hội ý có thể sử dụng qua TM ngoại biên không ?
-> Theo HDSD, Smoflipid CÓ THỂ sử dụng qua tĩnh mạch ngoại vi hoặc tĩnh mạch trung tâm.;
BN Rx Esomeprazol 20mg cho chỉ định Dự phòng loét dạ dày do stress. *Vấn đề: BN dùng thuốc qua sonde, BS chỉ định Jiracek 20mg
-> Biệt dược Jiracek không dùng được qua sonde, khuyến cáo đổi Stadnex 40mg (do viên 20mg hiện không có)
-> Các PPIs dùng được qua sonde dạ dày tại BVBNĐ theo bảng dưới

Bệnh nhân nam, 56t, 54 kg, 160 cm. Chẩn đoán: Sốc nhiễm trùng do Aeromonas veronii đa nhạy; Tổn thương thận cấp vô niệu (CRRT); Viêm mô tế bào vùng hông lưng 2 bên. Rx Imipenem/Cilastatin + Levofloxacin + Linezolid. *Vấn đề: Bệnh nhân ghi nhận tiểu cầu giảm (mức PLT đã thấp trước khi Rx Linezolid): PLT 11 4 12 8 Ku/L (đã truyền tiểu cầu); Nóng đỏ da vùng hông lưng + đùi (P) và hông lưng (T) tăng thêm, giới hạn không rõ, ấn đau nhiều
-> Khuyến cáo: 1) Ngưng Linezolid, chuyển sang Vancomycin; 2) Cân nhắc nguy cơ và lợi ích khi Rx Linezolid trên bệnh nhân có giảm PLT
Bệnh nhân nam, 56t, 54 kg, 160 cm. Chẩn đoán: Sốc nhiễm trùng do Aeromonas veronii đa nhạy; Tổn thương thận cấp vô niệu; Viêm mô tế bào vùng hông lưng 2 bên. Rx Imipenem/Cilastatin + Levofloxacin + Linezolid. *Vấn đề: Bệnh nhân ghi nhận tiểu cầu giảm: PLT 11 --> 4 --> 12 --> 8 Ku/L (đã có truyền tiểu cầu); Nóng đỏ da vùng hông lưng + đùi (P) và hông lưng (T) tăng thêm, giới hạn không rõ, ấn đau nhiều
-> Khuyến cáo: 1) Ngưng Linezolid 2) Chuyển sang Vancomycin, LD 1g truyền trong 2h, MD 1g truyền tĩnh mạch liên tục trong 24h. Đo kiểm tra Css sau 18h tính từ khi bắt đầu liều MD. Hội chẩn DLS khi có kết quả
Chẩn đoán: Theo dõi Dị ứng da hoặc Mày đay, tăng bạch cầu ái toan hoặc tiền sử nhiễm giun đũa chó, viêm da cơ địa dị ứng Rx Methylprednisolon 16mg hoặc Prednisolon 5mg hoặc 20mg x 1 lần/ngày x 10 ngày
-> Theo phác đồ điều trị mày đay (bệnh viện Bệnh Nhiệt Đới), trong những trường hợp mày đay nặng hay những trường hợp đáp ứng kém với các thuốc kháng Histamin có thể dùng Prednisolon 20-30mg/ngày trong 3-7 ngày.
-> Khuyến cáo thời gian điều trị 7 ngày
-> BS điều trị không đồng ý (04 trường hợp).
Chẩn đoán: Sốt rét ác tính thể mật độ cao (P. falciparum) /Thai 32 tuần 5 ngày con so. Rx Artesunat 120mg TMC giờ 24. *Vấn đề: BN sốt rét ác tính thể mật độ cao hiện. BN tỉnh, sốt giảm, còn sốt 1 cữ 37.8 / ngày, ăn uống, đi lại khá, tiêu tiểu bình thường + thai 32 tuần 5 ngày. BS hội chẩn chọn thuốc điều trị sốt rét trên phụ nữ mang thai.
-> Hiện tại không có đủ dữ liệu tin cậy về việc sử dụng Pyramax trên phụ nữ có thai cân nhắc tiếp tục sử dụng Artesunat 7 ngày tiêm tĩnh mạch + tư vấn BN theo dõi các triệu chứng tái nhiễm sốt rét sau khi xuất viện
BN Chẩn đoán: Nhiễm HSV lan tỏa, Nhiễm trùng huyết nghi từ viêm hoại tử cổ tử cung, Nhiễm nấm da, TD Viêm gan do HSV, Viêm gan do thuốc, Trào ngược dạ dày tá tràng, Rối loạn điện giải, CĐPB:TD Ung thư tử cung, Kháng sinh:- Vancomycin 750 mg/12h, - Metronidazol 500mg/8h, - Meropenem 1g/8h, - Acyclovir 500mg/8h (ngày 7-8). Ngày 27/9 Rx Fluconazol Voriconazol Rx nấm da do Candida parapsilosis (sang thương da 22/9)
-> Theo Kháng nấm đồ Khuyến cáo đề nghị sử dụng Itraconazol (MIC 0.25) còn nhạy để Rx nấm da thay cho Voriconazol. (Ngày 25/9 sang thương da Candida albicans, phết họng thấy nấm hạt men (+), cấy máu và NT (-)). Voriconazol là thuốc kháng nấm Rx trong TH nhiễm nấm xâm lấn và nhiễm nấm huyết. Điều kiện khi thanh toán BHYT như sau: Quỹ bảo hiểm y tế thanh toán 50% trong điều trị.
-> BS điều trị không đồng ý do Hội ý khoa sau đó nghi ngờ nhiễm nấm huyết do BN cơ địa đặc biệt nghi ngờ K tử cung và nhiễm HSV lan tỏa. Rx: Amphotericin B, theo dõi chặt chức năng thận do đang sử dụng Vancomycin.
Bệnh nhân nữ, 49kg, 58 jg, 158 cm. Chẩn đoán: Sốt xuất huyết dengue nặng N7; Thể sốc vào sốc lúc 18h 40 ngày 23/09 tái sốc 1 lần; Tổn thương gan nặng - Rối loạn đông máu ; Suy gan cấp - TD Bệnh não gan; Xuất huyết tiêu hóa do loét dạ dày tá tràng; Sốc nhiễm trùng;TD Nhiễm nấm xâm lấn. AST/ALT = 28985/3404. Rx NAC (Mucocil) 300mg/3mL/ ống, 12 ống q12h. Mỗi cử pha trong 500 mL dung Glucose 5%. *Vấn đề: BN quá tải dịch, cần hạn chế V (nhập)
-> NAC có thể pha tối thiểu trong 100 mL dung dich Glucose 5% (cho phép 100-250 mL dung dịch) Tham khảo: NSX(Mucocil), UKCPA: Minimum Infusion Volumes for Fluid Restricted Critically Ill Patients 4th Edition (v4.4) December 2012.
Bệnh nhân viêm phổi, ho đàm, tiền căn COPD. Rx Bromhexin. Bác sĩ hỏi có sử dụng được cho bệnh nhân COPD hay không?
-> Các thuốc long đờm - loãng đờm có trong nội viện:1) Bromhexin, Acetylcystein : CCĐ cho bệnh nhân hen hoặc co thắt phế quản; 2) Eprazinon: Không có CCĐ Khuyến cáo có thể cân nhắc sử dụng Eprazinon cho BN COPD
Tương tác thuốc:
Trong nội trú, số cảnh báo tương tác thuốc trung bình 1014 pDDIs tăng trong quý 3/2024 và tăng so với 6 tháng đầu năm (890 pDDIs). Tỷ lệ cảnh báo tương tác thuốc mức độ 4 khoảng từ 27% -31%, tăng so với cùng kỳ năm 2023 (16%- 19%). Riêng cảnh báo tương tác thuốc mức 5 có tỷ lệ và số lượng giảm hẳn so với năm 2023 (2,7%), chỉ còn khoảng 0,6% tương tự 6 tháng đầu năm. Đối với ngoại trú, từ tháng 4 đến nay chưa ghi nhận tương tác mức độ ở ngoại trú là nhờ vào việc cập nhật công cụ cảnh báo tương tác thuốc mức 5 trên Ehospital. Tăng cường hoạt động can thiệp DLS trên các cặp tương tác thuốc mức 4, 5 có nguy cơ ảnh hưởng đến điều trị.
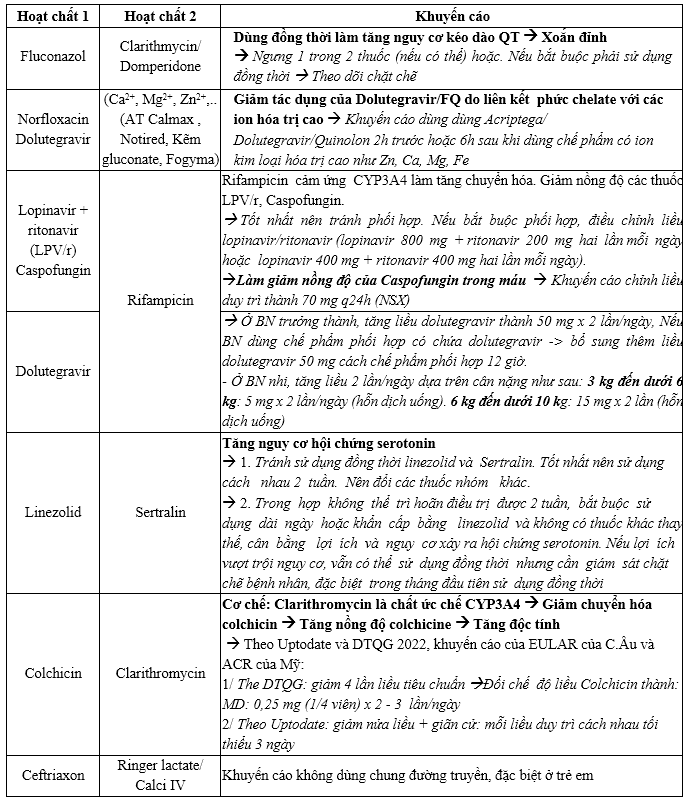
Bảng 3.4. Bảng các tương tác thuốc có khả năng xảy ra có mức độ tương tác là 5 – Severe
Khuyến cáo Hội đồng thuốc và điều trị - Ban Quản lý sử dụng kháng sinh
- Trong tháng 7/2024, Ban quản lý sử dụng kháng sinh thực hiện giám sát 119 HSBA về sử dụng kháng sinh tại các khoa: CCHSTC-CĐ NL, Nhiễm A, C, D, E, Nhiễm Việt Anh và Nội A; khuyến cáo các nội dung sau:
Ghi nhận Chiều cao - cân nặng đầy đủ
Tỷ lệ không phân tầng/phân tầng không hợp lý: 27%, cao nhất từ trước đến giờ khi khảo sát. 10/17 ca không phân tầng do dùng PO. Phân tầng không hợp lý bao gồm: Phân tầng cao hơn thực tế: THA ko phải là yếu tố nguy cơ; đi khám bệnh khác với nhập viện hoặc nằm ICU; bệnh nhân gan không phân theo CLIF-SOFA. Cần ghi nhận phân tầng trong phần y lệnh, một số hồ sơ chỉ ghi ở phiếu hội chẩn nên bỏ sót đối với KS không dùng KS hạn chế.
Cấy VS 92%, tỷ lệ cấy (+) 26%. Các ca không cấy chủ yếu dùng KS PO
Tỷ lệ sử dụng KS khởi đầu không hợp lý 12% (tương ứng 14 ca: 04 ca không nghĩ nhiễm trùng, 05 ca sử dụng không phù hợp (azithromycin chuyển hóa qua gan dùng cho BN suy gan, nhiều loại ks phối hợp không rõ lý do, phối hợp thêm azithromycin không cần thiết, trùng nhóm thuốc tiền sử có dị ứng); 5 ca PT sai.). Không sử dụng khởi đầu là 1%.
62% có đánh giá lâm sàng sau 48-72h; 68% đánh giá LS khi kết thúc đợt điều trị. Tỷ lệ thấp.
Về outcome 81% tốt, thấp hơn so với các lần đánh giá trước (do có hồ sơ khoa Nhiễm E). Chuyển viện 5%. Tỷ lệ có KSĐ 26%. 03/07 TH không nhạy với KSBĐ nhưng outcome tốt
Tỷ lệ dùng KS phối hợp là 44%, rất cao, Tỷ lệ Xuống thang kháng sinh: 9%
Thời gian dùng KS trung bình không dài DOT 11,4 ngày , tuy nhiên do số ca nặng xin về nhiều.
Có 05 ca dùng kháng nấm (02/05 ca có outcome tốt). Thời gian dùng Kháng nấm ngắn DOT 6.6 do bệnh nặng. Cần lưu ý thời gian điều trị kháng nấm.
Có ca không khai thác tiền sử dùng thuốc, BN đã tự ý mua Linezolide uống 6 tháng, vào viện chẩn đoán Gram (+) dùng tiếp Vanco
Lưu ý liều Cotrim lúc xuất viện: 960mg x 2 (chưa đủ vì BN 100kg)
- Hội đồng thuốc có TB số 10/24 khuyến cáo về việc sử dụng thuốc:
Không sử dụng Amoxicillin+acid clavuclanic chế độ liều 2 viên 500mg+125mg (tỷ lệ 4:1) x 2-3 lần/ngày vì liều acid clavuclanic cao có thể gây tác dụng phụ trên đường tiêu hóa.
Liều khuyến cáo của Amoxicillin+acid clavuclanic: 500mg+125mg: 1 viên x 3 lần/ngày hoặc 875+125mg: 1 viên x 2 lần/ngày.
Liều acid clavuclanic ≤ 10mg/kg/ngày nhằm hạn chế tác dụng phụ trên đường tiêu hóa. (Theo Uptodate 2024, NSX).
- Tuân thủ hướng dẫn theo Phác đồ điều trị của Bệnh viện Bệnh Nhiệt đới. Kháng sinh chỉ định Viêm mô tế bào liên quan thú nuôi cắn: Chọn lựa một trong các thuốc sau:
Amoxicillin+clavulanate/Doxycyclin/Cotrim/Penicillin/Cefuroxim/Moxifloxacin.
Phối hợp: Metronidazol/Clindamycin.
4. CHUYÊN ĐỀ: TIẾP CẬN CA LÂM SÀNG BỆNH CẢNH PHỨC TẠP KÈM PHẢN VỆ ĐỘ II VỚI ACYCLOVIR:










DS. Đặng Phạm Xuân Cương - Đơn vị TTT-DLS BVBNĐ
TÀI LIỆU THAM KHẢO
- Bệnh viện Bệnh Nhiệt Đới. (2024, January 19). Zona. http://emed.bvbnd.vn/wiki/phac-do/pd-dt/zona/
- Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh (CDC) Hoa Kỳ. (n.d.). Clinical Overview of Shingles (Herpes Zoster). Retrieved October 6, 2024, from https://www.cdc.gov/shingles/hcp/clinical-overview/index.html
- Yanni, E. A., Ferreira, G., Guennec, M., El Hahi, Y., El Ghachi, A., Haguinet, F., Espie, E., & Bianco, V. (2018). Burden of herpes zoster in 16 selected immunocompromised populations in England: A cohort study in the Clinical Practice Research Datalink 2000–2012. BMJ Open, 8(6), e020528. https://doi.org/10.1136/bmjopen-2017-020528
- Da Silva, A. M. P. D. S., De Moraes-Pinto, M. I., Succi, R. C. M., Terreri, M. T., & Machado, D. M. (2020). Clinical and Laboratory Characteristics of Herpes Zoster in Patients With HIV/AIDS and Those With Juvenile Systemic Lupus Erythematosus. Pediatric Infectious Disease Journal, 39(7), 624–627. https://doi.org/10.1097/INF.0000000000002617
- Wood, M. J., Kay, R., Dworkin, R. H., Soong, S.-J., & Whitley, R. J. (1996). Oral Acyclovir Therapy Accelerates Pain Resolution in Patients with Herpes Zoster: A Meta-analysis of Placebo-Controlled Trials. Clinical Infectious Diseases, 22(2), 341–347. https://doi.org/10.1093/clinids/22.2.341
- Jackson, J. L., Gibbons, R., Meyer, G., & Inouye, L. (1997). The effect of treating herpes zoster with oral acyclovir in preventing postherpetic neuralgia. A meta-analysis. Archives of Internal Medicine, 157(8), 909-912
- Crooks, R. J., Jones, D. A., & Fiddian, A. P. (1991). Zoster-associated chronic pain: An overview of clinical trials with acyclovir. Scandinavian Journal of Infectious Diseases. Supplementum, 80, 62–68.
- Cục Quản lý Dược—Bộ Y tế. (n.d.). Retrieved October 4, 2024, from https://dichvucong.dav.gov.vn/congbothuoc/index
- What’s New: Adult and Adolescent OIs HIV Clinical Guidelines | NIH. (2024, September 16). https://clinicalinfo.hiv.gov/en/guidelines/hiv-clinical-guidelines-adult-and-adolescent-opportunistic-infections/whats-new
- Acyclovir (systemic): Drug information. (n.d.). Uptodate. Retrieved October 7, 2024, from https://www.uptodate.com/contents/acyclovir-systemic-drug-information
- Famciclovir: Drug information. (n.d.). Uptodate. Retrieved October 7, 2024, from https://www.uptodate.com/contents/famciclovir-drug-information
- Valacyclovir: Drug information. (n.d.). Uptodate. Retrieved October 7, 2024, from https://www.uptodate.com/contents/valacyclovir-drug-information
- GlaxoSmithKline. (2007, November). Zovirax (acyclovir) prescribing information. Research Triangle Park.
- Casimir-Brown, R. S., Kennard, L., Kayode, O. S., Siew, L. Q. C., Makris, M., Tsilochristou, O., Chytiroglou, E., Nakonechna, A., Rutkowski, K., Mirakian, R., & Wagner, A. (2021). Piperacillin-Tazobactam Hypersensitivity: A Large, Multicenter Analysis. The Journal of Allergy and Clinical Immunology: In Practice, 9(5), 2001–2009. https://doi.org/10.1016/j.jaip.2020.12.051
- Parikh, R., Spence, O., Giannelos, N., & Kaan, I. (2024). Herpes Zoster Recurrence: A Narrative Review of the Literature. Dermatology and Therapy, 14(3), 569–592. https://doi.org/10.1007/s13555-024-01101-7
- Ha, J. W., Lee, J. Y., Her, Y., Kim, C. W., & Kim, S. S. (2017). Frequency of Herpes Zoster Recurrence in Central District of Korea. Annals of Dermatology, 29(5), 602. https://doi.org/10.5021/ad.2017.29.5.602
- Kim, Y. J., Lee, C. N., Lee, M. S., Lee, J. H., Lee, J. Y., Han, K., & Park, Y. M. (2019). Recurrence Rate of Herpes Zoster and Its Risk Factors: A Population-based Cohort Study. Journal of Korean Medical Science, 34(2), e1. https://doi.org/10.3346/jkms.2019.34.e1
- Coopman, S. A., Johnson, R. A., Platt, R., & Stern, R. S. (1993). Cutaneous Disease and Drug Reactions in HIV Infection. New England Journal of Medicine, 328(23), 1670–1674. https://doi.org/10.1056/NEJM199306103282304
- Bayrou, O., Gaouar, H., & Leynadier, F. (2000). Famciclovir as a possible alternative treatment in some cases of allergy to acyclovir. Contact Dermatitis, 42(1), 42–55. https://doi.org/10.1034/j.1600-0536.2000.042001042.x
- Lammintausta, K., Mäkelä, L., & Kalimo, K. (2001). Rapid systemic valaciclovir reaction subsequent to aciclovir contact allergy. Contact Dermatitis, 45(3), 181–181. https://doi.org/10.1034/j.1600-0536.2001.045003181.x
- Tyring, S., Belanger, R., Bezwoda, W., Ljungman, P., Boon, R., & Saltzman, R. L. (2001). A Randomized, Double-Blind Trial of Famciclovir Versus Acyclovir for the Treatment of Localized Dermatomal Herpes Zoster in Immunocompromised Patients. Cancer Investigation, 19(1), 13–22. https://doi.org/10.1081/CNV-100000070
- Shah, S. A., Gulbis, A., & Wilhelm, K. (2015). A case series using famciclovir in stem cell transplant recipients with valacyclovir hypersensitivity reactions. Journal of Oncology Pharmacy Practice, 21(4), 305–309. https://doi.org/10.1177/1078155214530599
- Choi, Y.-G., Park, H. J., Yim, S., Lee, H. J., Choi, Y. J., Kim, W.-S., & Lee, G.-Y. (2023). Fixed Drug Eruption in a Patient Taking Valacyclovir without Cross-Reactivity to Acyclovir. Annals of Dermatology, 35, e43. https://doi.org/10.5021/ad.21.074
- Schuster, J., Fabri, M., Eming, S., & Hunzelmann, N. (2008). Allergic Drug Eruption Secondary to Intravenous Acyclovir. Acta Dermato-Venereologica, 88(2), 196–198. https://doi.org/10.2340/00015555-0379
- Treatment of herpes zoster—UpToDate. (n.d.). Retrieved October 4, 2024, from https://www.uptodate.com/contents/treatment-of-herpes-zoster?source=mostViewed_widget
- Razonable, R. R. (2011). Antiviral Drugs for Viruses Other Than Human Immunodeficiency Virus. Mayo Clinic Proceedings, 86(10), 1009–1026. https://doi.org/10.4065/mcp.2011.0309
- Martinez, C. M., & Luks-Golger, D. B. (1997). Cidofovir use in acyclovir-resistant herpes infection. The Annals of Pharmacotherapy, 31(12), 1519–1521.
- Chastain, D. B., Hutzley, V. J., Parekh, J., & Alegro, J. V. G. (2019). Antimicrobial Desensitization: A Review of Published Protocols. Pharmacy, 7(3), 112. https://doi.org/10.3390/pharmacy7030112
- Simons, F. E. R. (2011). Anaphylaxis pathogenesis and treatment. Allergy, 66(s95), 31–34. https://doi.org/10.1111/j.1398-9995.2011.02629.x
- Scherer, K., Brockow, K., Aberer, W., Gooi, J. H. C., Demoly, P., Romano, A., Schnyder, B., Whitaker, P., Cernadas, J. S. R., Bircher, A. J., & for ENDA, the European Network on Drug Allergy and the EAACI Drug Allergy Interest Group. (2013). Desensitization in delayed drug hypersensitivity reactions – an EAACI position paper of the Drug Allergy Interest Group. Allergy, 68(7), 844–852. https://doi.org/10.1111/all.12161
- Castells, M. (2009). Rapid Desensitization for Hypersensitivity Reactions to Medications. Immunology and Allergy Clinics of North America, 29(3), 585–606. https://doi.org/10.1016/j.iac.2009.04.012
- Henry, R. E., Wegmann, J. A., Hartle, J. E., & Christopher, G. W. (1993). Successful oral acyclovir desensitization. Annals of Allergy, 70(5), 386–388.
- Snape, S. E., Finch, R. G., & Venkatesan, P. (2011). Aciclovir desensitisation and rechallenge. Case Reports, 2011(mar01 1), bcr1020103392–bcr1020103392. https://doi.org/10.1136/bcr.10.2010.3392
- Kawsar, M. (2001). Graded challenge in an aciclovir allergic patient. Sexually Transmitted Infections, 77(3), 204–205. https://doi.org/10.1136/sti.77.3.204
- Seki, J. T., Ng, P., Lam, W., Cote, J., & Prica, A. (2017). Recurrent Body Rash Warranted Second Desensitization With Acyclovir in a Myeloma Patient: A Case Report. Journal of Clinical Medicine Research, 9(8), 725–728. https://doi.org/10.14740/jocmr2772w
- Arslan Gülen, T., Özden, G., & Turanç, T. (2022). Asiklovir Alerjisinde İntravenöz Asiklovir Desensitizasyon Tedavisi: Herpes Ensefaliti Olgusu [Treatment with Intravenous Acyclovir Desensitization for Severe Acyclovir Allergy: A Case of Herpes Encephalitis]. Mikrobiyol Bul., 56(2), 371–376.
- Jain, S., & Passi, G. R. (2019). Rapid Desensitization for Acyclovir Hypersensitivity. The Indian Journal of Pediatrics, 86(11), 1054–1055. https://doi.org/10.1007/s12098-019-03004-4
- Andrade, D. C., Fatakhova, M., Fatteh, S., & Rubio-Gomez, H. (2021). A case of successful acyclovir desensitization in a bone marrow transplant patient. Journal of Oncology Pharmacy Practice, 27(4), 1033–1036. https://doi.org/10.1177/1078155220959408
- Executive summary of disease management of drug hypersensitivity: A practice parameter. Joint Task Force on Practice Parameters, the American Academy of Allergy, Asthma and Immunology, the American Academy of Allergy, Asthma and Immunology, and the Joint Council of Allergy, Asthma and Immunology. (1999). Annals of Allergy, Asthma & Immunology: Official Publication of the American College of Allergy, Asthma, & Immunology, 83(6 Pt 3), 665–700.