Viêm gan siêu vi (VGSV) là bệnh gan do các loại virus có ái tính với tế bào gan gây ra hội chứng viêm và hoại tử. Hiện nay, có 6 loại virus gây viêm gan nguyên phát được xác định: HAV, HBV, HCV, HDV, HEV, HGV.
Dựa vào biểu hiện lâm sàng và biến đổi xét nghiệm, VGSV được chia làm 2 loại:
VGSV cấp: triệu chứng lâm sàng và bất thường về xét nghiệm chức năng gan kéo dài không quá 6 tháng.
VGSV mạn: triệu chứng lâm sàng và bất thường về xét nghiệm chức năng gan kéo dài trên 6 tháng.
A. VIÊM GAN SIÊU VI CẤP
I. CHẨN ĐOÁN
I.1. Chẩn đoán sơ bộ
I.1.1. Dịch tễ:
- Tiền căn gia đình: có người thân bị viêm gan.
- Tiền căn cá nhân: có quan hệ tình dục không bảo vệ, dùng chung kim tiêm, thủ thuật xuyên qua da, truyền máu từ 2 tuần đến 6 tháng trước khi có triệu chứng đầu tiên của bệnh.
I.1.2. Lâm sàng:
Khoảng 70 - 80% bênh nhân không có triệu chứng lâm sàng rõ ràng.
- Bệnh nhân có thể biểu hiện một hay nhiều triệu chứng sau:
- Không sốt hoặc sốt nhẹ.
- Mệt mỏi, uể oải.
- Rối loạn tiêu hóa: nôn ói, chán ăn, đau hạ sườn phải.
- Vàng mắt, vàng da, tiểu vàng.
- Gan to và đau.
- Nếu bệnh nặng, diễn tiến tối cấp, có thể rối loạn tri giác, xuất huyết da niêm, gan teo, …
I.1.3. Cận lâm sàng
AST (SGOT) và ALT (SGPT) tăng, thường trên 5 lần giới hạn trên của mức bình thường (ULN: upper limit of normal). Giá trị của UNL: 35 U/L đối với nam, 25 U/L đối với nữ; áp dụng cho cả trẻ em.
I.2. Chẩn đoán xác định
Các ca bệnh có biểu hiện lâm sàng và yếu tố dịch tễ (có thể có) nghi ngờ VGSV cấp, có thể được thực hiện các xét nghiệm hyết thanh lần lượt như sau:
- Trước tiên nên làm các xét nghiệm Anti-HAV IgM, Anti-HBc IgM và HBsAg
- Anti-HAV IgM (+): VGSV A cấp.
- Anti-HBc IgM (+): VGSV B cấp.
- Nếu HBsAg âm, Anti-HAV IgM âm và Anti-HBc IgM âm, chẩn đoán tạm thời là VGSV cấp không A - không B và lần lượt làm tiếp các xét nghiệm:
- Anti-HCV: Trong nhiễm HCV cấp, Anti-HCV có thể âm trong vài tuần đầu rồi dương sau 8 - 12 tuần phơi nhiễm. Chẩn đoán nhiễm HCV cấp khi: có chuyển Anti-HCV từ âm sang dương trong vòng 6 tháng hoặc Anti-HCV âm và HCV RNA (hoặc HCVcoreAg) dương. Anti-HCV có thể được xem xét thực hiện cùng lúc với các xét nghiệm Anti-HAV IgM, Anti-HBc IgM khi xác định tác nhân VGSV cấp.
- Nếu Anti-HCV âm, làm xét nghiệm Anti-HEV IgM. Nếu Anti-HEV IgM dương: VGSV E cấp.
- Khi Anti-HCV âm, nếu không tìm được các nguyên nhân gây viêm gan cấp mà có lâm sàng và/hoặc yếu tố dịch tễ nghi ngờ, có thể làm HCV RNA hoặc HCVcoreAg hoặc sau 8 đến 12 tuần làm lại xét nghiệm Anti-HCV để xác định chẩn đoán VGSV C cấp.
- Đối với người lọc máu (chạy thận nhân tạo) hoặc suy giảm miễn dịch nặng có xét nghiệm anti-HCV âm nhưng có biểu hiện của bệnh gan, nên xét nghiệm HCV-RNA hoặc HCV coreAg.
II. ĐIỀU TRỊ
Bệnh nhân nghi ngờ VGSV cấp có các dấu hiệu nặng sau đây cần được nhập viện để theo dõi và điều trị:
- Trụy tim mạch.
- Rối loạn tri giác.
- Rối loạn hô hấp.
- Xuất huyết.
- Nôn nhiều.
- Không ăn uống được.
- Sốt cao.
- Vàng da niêm với bilirubin toàn phần tăng trên 10 lần giá trị bình thường.
- AST hoặc ALT tăng cao trên 10 lần giá trị bình thường.
II.1. Chế độ ăn
- Khẩu phần nhiều đạm, nhiều đường, ít mỡ.
- Không bia rượu.
- Không kiêng ăn thái quá. Nên ăn những thức ăn dễ tiêu hóa, khuyến khích bệnh nhân ăn nhiều lần, mỗi lần một ít. Nên dùng bữa ăn chính vào lúc sáng và trưa, ăn nhẹ vào chiều, tối. Chỉ nuôi dưỡng tạm thời bằng đường tĩnh mạch khi người bệnh bị nôn nhiều hay không ăn uống được.
II.2. Điều trị
- Hạn chế các loại thuốc có thể gây viêm gan nặng hơn, không dùng Corticoid, cẩn thận khi sử dụng Phenobarbital, thuốc kháng lao, kháng sinh nhóm Cyclin...
- Vitamin K1: 10 mg/ngày tiêm bắp hoặc pha loãng tiêm mạch chậm 1mg/phút, 3 - 5 ngày khi Prothrombin giảm < 60%.
- Điều trị hồi sức nội khoa tích cực với các trường hợp nặng có chỉ định.
- Các loại thuốc hỗ trợ gan giúp cải thiện triệu chứng lâm sàng, có thể được xem xét sử dụng.
-
Điều trị thuốc kháng siêu vi.
-
Đối với VGSV B cấp:
Chỉ định điều trị với Entecavir (ETV) 0,5 mg/ngày hoặc Tenofovir disoproxil fumarat (TDF) 300 mg/ngày hoặc Tenofovir alafenamide (TAF) 25 mg/ngày cho đến khi mất HBsAg đối với các trường hợp sau:
- VGSV B thể tối cấp.
- VGSV B cấp có ≥ 2 tiêu chí sau:
- Bệnh não gan
- Bilirubin TP huyết thanh > 3 mg/dL hay > 51 µmol/L hoặc Bilirubin TT > 1,5 mg/dL hay > 25 µmol/L
- INR > 1,5
- Bệnh kéo dài > 4 tuần với bilirubin có xu hướng tăng- Đối với VGSV C cấp:
Khoảng 20-50% người bệnh nhiễm HCV cấp có thể tự khỏi.
- Điều trị:
- Đặc hiệu: sofosbuvir/velpatasvir hoặc glecaprevir/pibrentasvir, trong 8 tuần
- Hỗ trợ: nghỉ ngơi và điều trị triệu chứngII.3. Nghỉ ngơi
- Không cần thiết nghỉ ngơi tuyệt đối và hoàn toàn tại giường nhưng làm việc nặng, gắng sức có thể làm cho bệnh diễn tiến phức tạp và kéo dài.
- Thời gian nghỉ ngơi nên đến khi hết vàng da - mắt và AST, ALT < 2 lần ULN.
- Không nên lao động nặng, gắng sức ít nhất là 3 tháng kể từ khi hết giai đoạn nghỉ ngơi.
II.4. Theo dõi thường xuyên về lâm sàng và xét nghiệm
II.4.1. Lâm sàng
Diễn tiến của vàng da - mắt, rối loạn tiêu hóa, tình trạng uể oải, mệt mỏi, có hay không xuất huyết, phù chi, báng bụng, rối loạn tri giác,…
II.4.2. Xét nghiệm
- AST và ALT mỗi 1 - 2 tuần cho đến khi ALT< 2 lần ULN, sau đó định kỳ mỗi 4 -12 tuần, ít nhất trong 24 tuần.
- Tỉ lệ prothrombin, INR, Bilirubin TP và TT mỗi 1 - 2 tuần có thể đến khi về trị số bình thường.
- Đối với VGSV B cấp, cần xét nghiệm thêm HBsAg, Anti-HBs tuần 12 và tuần 24. Nếu HBsAg âm và Anti-HBs dương hoặc âm: bệnh nhân VGSV B cấp hồi phục.
- Đối với VGSV C cấp, xét nghiệm HCV RNA ở tuần thứ 12 sau điều trị để đánh giá khả năng khỏi bệnh (đạt SVR 12).
- Siêu âm bụng để phát hiện các bệnh gây tắc mật.
B. VIÊM GAN SIÊU VI MẠN
Các virus có thể gây VGSV mạn là: HBV, HCV, HDV, HEV và HGV. Tại nước ta, hai loại virus quan trọng thường gặp nhất là HBV và HCV.
I. CHẨN ĐOÁN VÀ ĐIỀU TRỊ VGSV B MẠN TÍNH
I.1. Chẩn đoán
I.1.1. Dịch tễ: giống như VGSV cấp
I.1.2. Lâm sàng:
Chán ăn, mệt mỏi, đau hạ sườn phải hoặc không có triệu chứng.
I.1.3. Cận lâm sàng:
- AST (SGOT), ALT (SGPT) gia tăng và kéo dài > 6 tháng.
- HBsAg (+) và kéo dài > 6 tháng hoặc Anti-HBc IgG (+) hoặc Anti-HBc IgM (-).
- HBeAg (+) hoặc (-).
I.2. Điều trị
I.2.1. Chỉ định điều trị đặc hiệu: cần đủ 2 tiêu chuẩn
- Bệnh VGSV B mạn đang tiến triển với AST, ALT > 2 lần ULN liên tục hay từng đợt kéo dài trên 6 tháng và/hoặc có bằng chứng gan đang tổn thương tiến triển, tăng độ xơ hóa. Có thể dựa vào sinh thiết gan hoặc đo độ đàn hồi gan (tăng trên 6 kPa giữa 2 lần đánh giá hoặc lần đầu ≥11 kPa), fibrotest, chỉ số xơ hóa...
- Virus đang tăng sinh được xác định trong 2 trường hợp sau:
- HBsAg (+), HBeAg (+) và HBV DNA (+) ≥ 105 copies/ml (20.000 IU/ml)
- Hoặc HBsAg (+), HBeAg () và HBV DNA (+) ≥ 104 copies/ml (2.000 IU/ml).
Dựa vào sự tăng sinh của HBV và khả năng bị đột biến, để thuận tiện cho việc điều trị, có thể chia ra làm 2 loại VGSV B mạn: VGSV B mạn với HBeAg (+) và VGSV B mạn với HBeAg (-).
I.2.2. Phác đồ điều trị:
I.2.2.1. Đối với bệnh nhân chưa điều trị bằng các thuốc ức chế HBV:
- Thuốc: được chọn là TDF hoặc ETV (uống) hoặc Peg-IFN alfa 2a hoặc 2b (tiêm).
- Liều dùng:
Trước khi điều trị với Peg-IFN, cần làm các xét nghiệm tầm soát các bệnh lý, cơ địa có thể ảnh hưởng kết quả điều trị hoặc chống chỉ định điều trị: công thức máu, đường huyết, creatinnin/máu, taux de prothrombin, albumin/máu, ANA, T4/TSH, ECG, XQ phổi thẳng, siêu âm bụng, siêu âm tim, test thử thai, HIV,...
I.2.2.2. Bệnh nhân đang điều trị thuốc Nucleos(t)ide analogues (NAs):
a. Xác định thất bại điều trị:
Nếu xảy ra một trong các trường hợp sau (khi đã kiểm tra sự tuân thủ điều trị của bệnh nhân và độ tin cậy của xét nghiệm):
- Không đáp ứng virus: HBV DNA giảm < 1 log10(10 lần) sau 12 tuần hoặc HBVDNA giảm < 2 log10(100 lần) sau 24 tuần điều trị.
- Đáp ứng virus một phần: HBV DNA vẫn trên ngưỡng phát hiện sau 6 tháng điều trị với LAM, ADV hoặc sau 12 tháng điều trị với ETV, TDF.
- Bùng phát virus: HBV DNA tăng > 1 log10(10 lần) so với trị số thấp nhất.
b.Thay đổi phác đồ khi thất bại điều trị:
- Đang điều trị với LAM và/hoặc Adefovir (ADV): chuyển sang LAM + TDF.
- Đang điều trị với phác đồ có ETV, TDF:
- Tiếp tục điều trị và kiểm tra sự tuân thủ điều trị của bệnh nhân trong 1 - 3 tháng.
- Sau đó, kiểm tra lại nồng độ HBV DNA với xét nghiệm PCR có độ nhạy cao, nếu xác định thất bại điều trị thì đổi thuốc hoặc phối hợp thuốc điều trị.
- Đang điều trị với TDF: phối hợp với LAM hoặc ETV hoặc FTC (Emtricitabin 200 mg/ngày).
- Đang điều trị với ETV: đổi sang TDF.
- Đang điều trị phối hợp TDF + LAM hoặc ETV + ADV: chuyển sang TDF+ETV.
I.2.2.3. Thời gian điều trị các thuốc NAs:
- VGSV B mạn tính có HBeAg (+): thuốc uống kéo dài ít nhất là 12 tháng. Có thể xem xét ngưng thuốc sau 6 - 12 tháng có chuyển đổi huyết thanh HBeAg và HBV DNA <20 IU/ml.
- VGSV B mạn tính có HBeAg (-): xem xét ngưng thuốc khi HBV DNA dưới ngưỡng phát hiện trong 3 lần xét nghiệm liên tiếp cách nhau mỗi 6 tháng. Vì bệnh rất dễ bị tái phát sau khi ngưng thuốc nên có thể tiếp tục điều trị đến khi mất HBsAg.
- Cần theo dõi tái phát sau ngừng thuốc qua tái khám định kỳ, xét nghiệm transaminase và định lượng HBV DNA hay khi có biểu hiện bệnh lý.
- Các trường hợp thất bại điều trị với NAs, nếu có điều kiện, nên xác định đột biến kháng thuốc bằng giải trình tự gen.
I.2.2.4. Điều trị VGSV B mạn trên một số cơ địa đặc biệt:
- VGSV B mạn biến chứng xơ gan: chỉ định điều trị với TDF hoặc ETV bất kể ALT, HBeAg, HBV DNA cho các trường hợp xơ gan còn hoặc mất bù (hoặc APRI > 2 ở người lớn). Không dùng IFN trên người xơ gan mất bù.
- Trẻ em: xem xét thực hiện theo lưu đồ:
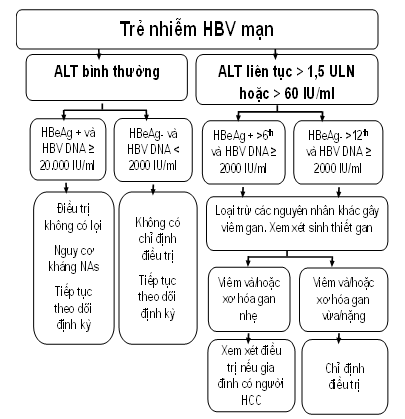
Trường hợp không sinh thiết được gan cần hội chẩn chuyên gia để quyết định
- Trẻ < 12 tuổi: LAM 3 mg/kg/ngày, không quá 100 mg/ngày hoặc IFN alfa 2a 6 MIU/m2 (không quá 10MIU/lần), 3 lần/tuần.
- Trẻ ≥ 12 tuổi: TDF (8 mg/kg/ngày, tối đa 300 mg/ngày); ADV (0,25 mg/kg/ngày, tối đa 10 mg/ngày),
- Trẻ ≥ 2tuổi và ≥10kg: ETV
| Cân nặng (kg) | Liều dùng (mg) |
|---|---|
| 10-11 kg | 0,15 mg |
| >11-14 kg | 0,20 mg |
| >14-17 kg | 0,25 mg |
| >17-20 kg | 0,30 mg |
| >20-23 kg | 0,35 mg |
| >23-26 kg | 0,40 mg |
| >26-30 kg | 0,45 mg |
Trường hợp kháng LAM thì tăng liều ETV gấp đôi
- Ưu tiên đặc biệt các trường hợp ALT trong khoảng 1 - 2 lần ULN, nồng độ HBV DNA cao (> 106 copies/ml), có tiền sử gia đình liên quan đến HCC, cần xem xét sinh thiết gan hoặc đo độ đàn hồi gan hoặc các xét nghiệm đánh giá mức độ xơ hóa để quyết định điều trị thuốc kháng virus.
- Phụ nữ VGSV B mạn và thai kỳ:
- Đang điều trị VGSV B mạn và có thai: nên tiếp tục các thuốc nhóm B trong bảng phân loại của FDA (như TDF). Thận trọng và không khuyến cáo dùng tiếp LAM, ADV, ETV (bảng C của FDA). Chống chỉ định dùng IFN/Peg-IFN cho phụ nữ có thai.
- Đang điều trị VGSV B mạn muốn có thai: nếu đang dùng thuốc ETV thì ngừng thuốc ETV trước khi có thai 2 tháng và chuyển sang dùng thuốc TDF.
- Đang mang thai phát hiện mắc VGSVB mạn: nếu có thể trì hoãn điều trị thì trì hoãn và theo dõi sát triệu chứng lâm sàng và xét nghiệm; nếu phải điều trị: dùng TDF.
- Trường hợp ung thư gan có HBsAg dương, nên xem xét điều trị bằng ETV hoặc TDF lâu dài trước và/hay sau khi điều trị ung thư gan.
- Đồng nhiễm HBV/HIV: tiêu chuẩn điều trị giống như đối với VGSV B mạn đơn thuần như ngưỡng HBV DNA > 2.000 IU/ml. Dùng phác đồ điều trị 3 thuốc kháng HIV có TDF + LAM (hoặc FTC), không phụ thuộc vào số lượng CD4.
- Những trường hợp đặc biệt khác, cần hội chẩn chuyên gia.
Bên cạnh điều trị đặc hiệu, khuyên bệnh nhân nên sắp xếp công việc để nghỉ ngơi, tránh lao động nặng, hạn chế các thuốc gây hại cho gan, không uống rượu bia.
I.2.3. Theo dõi
- Trong thời gian điều trị:
- Các triệu chứng lâm sàng.
- Nếu điều trị với IFN/Peg-IFN cần lưu ý phát hiện, xử lý các tác dụng bất lợi của thuốc.
- Xét nghiệm: transaminase, creatinin, HBeAg, Anti-HBe, mỗi 3 tháng, HBV DNA mỗi 3 - 6 tháng/lần. Xem xét làm HBsAg định lượng để đánh giá, tiên lượng điều trị.
- Sau khi ngưng điều trị
- Các triệu chứng lâm sàng
- Xét nghiệm transaminase, HBsAg, HBeAg, Anti-HBe, HBV DNA mỗi 3 – 6 tháng để đánh giá tái phát.
Các xét nghiệm đánh giá, theo dõi biến chứng xơ gan, ung thư gan: công thức máu, AFP, siêu âm bụng cần thực hiện ít nhất 1 lần mỗi 6 tháng cho các trường hợp nhiễm HBV mạn, trong quá trình điều trị hoặc sau điều trị VGSV B mạn với các thuốc kháng virus. Khi siêu âm bụng chưa loại trừ tổn thương u gan và/hoặc AFP tăng cao bất thường (> 400 ng/ml) cần khảo sát thêm CT Scan bụng cản quang hoặc Cộng hưởng từ bụng.
Ung thư gan hoặc xơ gan mất bù vẫn có thể xảy ra trong và sau khi điều trị.
I.3. Điều trị dự phòng
I.3.1. Dự phòng lây truyền HBV từ mẹ sang con
- Trẻ sinh ra từ mẹ nhiễm HBV cần được tiêm ngừa sau sinh với HBIG và vắc-xin ngừa HBV, tốt nhất trong vòng 12 giờ sau sanh.
- Trường hợp mẹ bị nhiễm HBV với nồng độ cao (HBV DNA > 106 copies/ml) hoặc HBeAg dương, cần được tư vấn và điều trị dự phòng lây truyền với Tenofovir từ tuần 28 của thai kỳ và duy trì 1 - 3 tháng sau sinh. Theo dõi sát mẹ sau khi ngưng thuốc dự phòng vì có thể xuất hiện viêm gan bùng phát.
- Có thể cho bé đã tiêm ngừa sau sinh bú mẹ.
I.3.2. Dự phòng VGSV B bùng phát khi điều trị hóa trị liệu hoặc thuốc ức chế miễn dịch (UCMD) cho người nhiễm HBV.
- Tất cả BN nhiễm HBV khi bị hóa trị liệu hoặc điều trị UCMD đều có nguy cơ tái hoạt HBV. Cần xét nghiệm HBsAg hoặc Anti-HBc IgG (nếu HBsAg âm) trước điều trị UCMD, hóa trị liệu, để xác định tình trạng nhiễm HBV và xem xét điều trị dự phòng VGSV B bùng phát bằng thuốc kháng virus (ETV, TDF hoặc LAM).
- Thời gian: tiếp tục ít nhất 12 tháng sau khi ngưng trị liệu UCMD, hóa trị liệu.
II. CHẨN ĐOÁN VÀ ĐIỀU TRỊ VGSV C MẠN TÍNH
II.1. Chẩn đoán
II.1.1. Dịch tễ: giống như VGSV B mạn.
II.1.2. Lâm sàng: giống như VGSV B mạn.
II.1.3. Cận lâm sàng
- AST/ALT gia tăng và kéo dài > 6 tháng.
- Anti-HCV (+) > 6 tháng
- Anti-HCV (+) và HCVRNA (+)hoặc HCV core-Ag (+).
- Trẻ em < 18 tháng tuổi: xét nghiệm HCV RNA lúc trẻ 6 tháng và 12 tháng. Chẩn đoán nhiễm HCV khi có ít nhất hai lần HCV RNA (+).
- Trẻ em trên 18 tháng tuổi chẩn đoán nhiễm HCV khi anti-HCV (+) và HCV RNA (+).
II. 2. Điều trị VGSV C mạn
II.2.1. Mục tiêu điều trị
- Loại trừ HCV ra khỏi cơ thể người bệnh (đạt được đáp ứng vi rút bền vững: tải lượng HCV RNA dưới ngưỡng phát hiện (< 15 IU/ml) ở tuần thứ 12 sau khi kết thúc điều trị, gọi là SVR 12. Tải lượng HCV RNA dưới ngưỡng phát hiện ở tuần thứ 24 sau khi kết thúc điều trị: SVR 24 được dùng khi người bệnh sử dụng phác đồ điều trị có Peg-interferon).
- Phòng ngừa các biến chứng về gan và các bệnh ngoài gan liên quan đến HCV
- Dự phòng lây nhiễm HCV trong cộng đồng.
II.2.2. Các thuốc điều trị
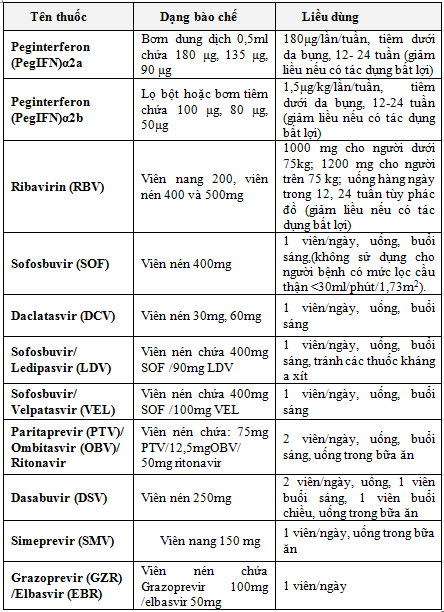
II.2.3. Chuẩn bị điều trị
- Người bệnh cần được khám lâm sàng toàn diện và làm các xét nghiệm (Phụ lục 1). Đối với phụ nữ trong tuổi sinh sản hoặc nghi ngờ có thai cần xét nghiệm thử thai định tính.
- Tư vấn cho người bệnh:
- Về đường lây nhiễm HCV để phòng lây nhiễm cho cộng đồng và tái nhiễm.
- Về các biến chứng của bệnh VGSV C và khả năng tái nhiễm mới.
- Về tác hại và nên tránh các thức uống có cồn (rượu bia).
- Về các phác đồ điều trị: hiệu quả, tác dụng không mong muốn của thuốc điều trị.
- Về khả năng sinh quái thai của các thuốc điều trị và hướng dẫn sử dụng các biện pháp tránh thai trong quá trình điều trị và 6 tháng sau điều trị đối với người bệnh và bạn tình.
- Về lợi ích của tuân thủ điều trị.
II.2.4. Chỉ định điều trị
- Khi người bệnh có đủ các điều kiện:
- HCV RNA (+) và anti-HCV(+)
- hoặc HCV RNA(+) và có chứng cứ nhiễm HCV mạn (có HCV Genotype hoặc HCV RNA dương hoặc HCVcoreAg (+)> 6 tháng)
- hoặc HCV RNA (+) và mức độ xơ hóa gan>F2
- Dựa vào xét nghiệm kiểu gen, các chống chỉ định, tương tác thuốc và bệnh đi kèm để lựa chọn các phác đồ.
- Lựa chọn ban đầu là các phác đồ sử dụng các thuốc DAAs. Các phác đồ có Peg-IFN nên là lựa chọn thay thế.
- Không xác định được kiểu gen: sử dụng phác đồ điều trị được cho kiểu gen 6.
- Các phác đồ sử dụng DAAs thế hệ mới, chưa đề cập trong hướng dẫn này, có thể được xem xét, bổ sung dựa theo các hướng dẫn chuyên môn của tổ chức y tế thế giới và các hiệp hội Gan mật Châu Á Thái Bình Dương, Châu Âu, Châu Mỹ và theo các quy định liên quan đến sử dụng thuốc tại Việt Nam
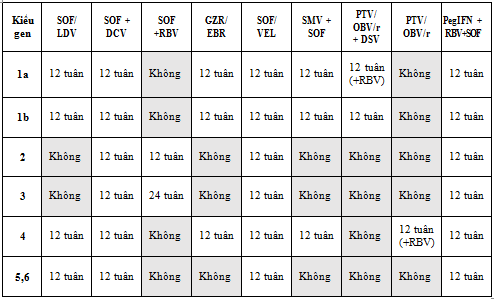

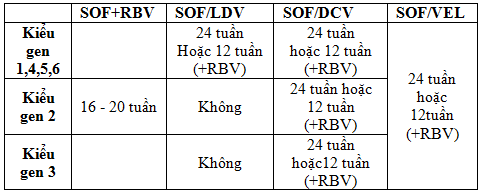
Lưu ý:
- Đối với phác đồ có sử dụng RBV thì khởi đầu với liều 600mg, tăng liều dần theo cân nặng nếu người bệnh dung nạp tốt. - Điều trị DAAs trên người bệnh xơ gan mất bù cần được theo dõi tại cơ sở điều trị chuyên khoa/đa khoa tuyến tỉnh hoặc tuyến trung ương.
II.2.5. Chống chỉ định
a) Đối với phác đồ có các thuốc DAAs
- Chưa có khuyến cáo điều trị các thuốc DAAs cho người bệnh dưới 18 tuổi.
- Phụ nữ có thai.
b) Đối với phác đồ có Peginterferon
- Chống chỉ định tuyệt đối: như Hướng dẫn 2013
- Chống chỉ định tương đối:
- Hemoglobin <13g/dL hoặc <12g/dL đối với phụ nữ; Bạch cầu đa nhân trung tính <1,5 G/L; Tiểu cầu < 90 G/L;
- Creatinin huyết thanh >1,5 mg/dL (> 132 μg/L).
- Bệnh về huyết sắc tố (hồng cầu hình liềm hoặc Thalassaemia).
- Bệnh mạch vành nặng; Bệnh tuyến giáp không điều trị.
- Viêm màng bồ đào, viêm võng mạc mắt, bệnh Glaucoma (Glôcôm).
c) Đối với phác đồ có ribavirin
- Chống chỉ định tuyệt đối:
- Thiếu máu nặng (hemoglobin < 8,0 g/dL).
- Phụ nữ có thai hoặc không muốn dùng biện pháp tránh thai; đang cho con bú.
- Đang mắc các bệnh nặng khác bao gồm cả các bệnh nhiễm trùng nặng.
- Suy tim không kiểm soát được; Bệnh phổi tắc nghẽn mạn tính.
- Chống chỉ định tương đối:
- Hemoglobin <10g/dL; bạch cầu trung tính < 1,5 G/L; tiểu cầu < 90 G/L.
- Creatinine huyết thanh >1,5mg/dL(> 132 μg/L).
- Bệnh huyết sắc tố (bệnh hồng cầu hình liềm hoặc thalassemia); Bệnh mạch vành nặng.
II.2.6. Điều trị viêm gan vi rút C ở một số trường hợp đặc biệt
a) Trẻ em: như Hướng dẫn 2013 - Bộ Y tế
b) Người bệnh viêm gan vi rút C đồng nhiễm HIV
- Điều trị tương tự như người bệnh VGSV C không nhiễm HIV, ưu tiên dùng phác đồ có DAAs.
- Điều trị ARV trước cho đến khi CD4 > 200 tế bào/mm3 hoặc tải lượng HIV RNA dưới ngưỡng ức chế (<1000 bản sao/ml) thì bắt đầu điều trị VGSV C mạn.
- Không dùng phác đồ có ritonavir cho người bệnh chưa được điều trị ARV.
- Khi điều trị HIV và điều trị VGSV C lưu ý tương tác thuốc giữa các thuốc DAAs và thuốc ARV.
c) Người bệnh đồng nhiễm HBV/HCV
- Điều trị giống người bệnh VGSV C.
- Nếu HBV đang tăng sinh (HBV DNA ≥ 2000UI/ml / HBeAg âm hoặc ≥20.000UI/ml / HBeAg dương: phối hợp thêm thuốc kháng HBV.
- Chú ý tương tác thuốc giữa LDV và TDF có thể tăng độc tính thận. Người bệnh cần được theo dõi chức năng thận thường xuyên nếu có sử dụng đồng thời 2 thuốc này.
d) Người bệnh có bệnh thận mạn tính
Đánh giá mức độ suy thận dựa vào độ thanh thải Creatinin (CrCl), từ đó lựa chọn thuốc, liều lượng thích hợp
e)Người bệnh đồng nhiễm lao/HCV
- Điều trị lao tiến triển trước, khi ổn định thì điều trị VGSV C.
- Điều trị giống người bệnh VGSV C.
- Khi điều trị lao và điều trị VGSV C lưu ý tương tác thuốc giữa các thuốc DAAs và rifampicin.
II.3. Theo dõi điều trị
II.3.1. Theo dõi tác dụng không mong muốn
- Theo dõi chặt chẽ các tác dụng không mong muốn của thuốc điều trị viêm gan C, đặc biệt đối với người bệnh sử dụng phác đồ có PegIFN, ribavirin, điều trị các bệnh kèm theo. Các thuốc DAAs có một số tác dụng phụ nhẹ, thường tự khỏi.
- Đối với người bệnh đang sử dụng các thuốc khác cần lưu ý tương tác thuốc giữa thuốc đang sử dụng với thuốc điều trị VGSV C.
II.3.2. Xử trí một số tác dụng phụ do PegIFN và ribavirin
a) Giảm bạch cầu: như Hướng dẫn 2013
b) Thiếu máu
- Đối với người bệnh không có bệnh tim mạch:
- Hb < 10g/dL: như Hướng dẫn 2013
- Hb 8,5-10g/dL: giảm liều PegIFN và ribavirin 50% cho đến liều 200mg/ngày.
- Hb <8,5g/dL: ngừng điều trị.
- Đối với người bệnh có tiền sử bệnh tim mạch ổn định: Giảm liều RBV nếu Hb giảm trên 2g/dL trong thời gian điều trị 4 tuần. Nếu sau 4 tuần giảm liều mà Hb < 12g/dL: ngừng điều trị RBV.
c) Giảm tiểu cầu: như Hướng dẫn 2013
d) Trầm cảm: như Hướng dẫn 2013
e) Rối loạn chức năng tuyến giáp: theo dõi FT4, TSH và hội chẩn chuyên khoa nội tiết.
II.3.3. Theo dõi đáp ứng điều trị viêm gan C mạn tính
Trong quá trình điều trị cần theo dõi đáp ứng điều trị thông qua các xét nghiệm (Phụ lục 1).
a) Điều trị khỏi
- Điều trị khỏi bệnh viêm gan vi rút C là khi người bệnh đạt đáp ứng vi rút bền vững sau 12 tuần kết thúc điều trị (đạt SVR 12). Cần theo dõi sau khi ngưng điều trị 24 tuần bằng xét nghiệm định lượng HCV RNA để bảo đảm người bệnh không bị tái phát.
- Theo dõi người bệnh sau khi điều trị khỏi:
- Theo dõi biến chứng HCC (kể cả người bệnh chưa điều trị), đặc biệt ở người bệnh có độ xơ hóa gan từ F3 trở lên: bằng siêu âm bụng và AFP mỗi 3-6 tháng. Có thể xem xét sử dụng các xét nghiệm:AFP-L3, PIVKA-II để phát hiện sớm HCC.
- Người bệnh có nguy cơ tái nhiễm HCV (tiêm chích ma túy) hoặc có tăng men gan trở lại: cần kiểm tra lại xét nghiệm định lượng HCV RNA để phát hiện bệnh tái phát hoặc nhiễm HCV mới.
b) Điều trị lại đối với người bệnh thất bại điều trị
Trường hợp thất bại điều trị là khi không đạt được đáp ứng vi rút bền vững ở tuần thứ 12 sau kết thúc điều trị (Bảng 4). Đối với các trường hợp thất bại điều trị, nên hội chẩn xin ý kiến chuyên gia để chọn lựa phác đồ thích hợp cho từng cá thể.
c) Ngừng điều trị
- Ngừng điều trị khi người bệnh có các tác dụng không mong muốn nặng, đe dọa tính mạng (đặc biệt đối với phác đồ có Peg IFN).
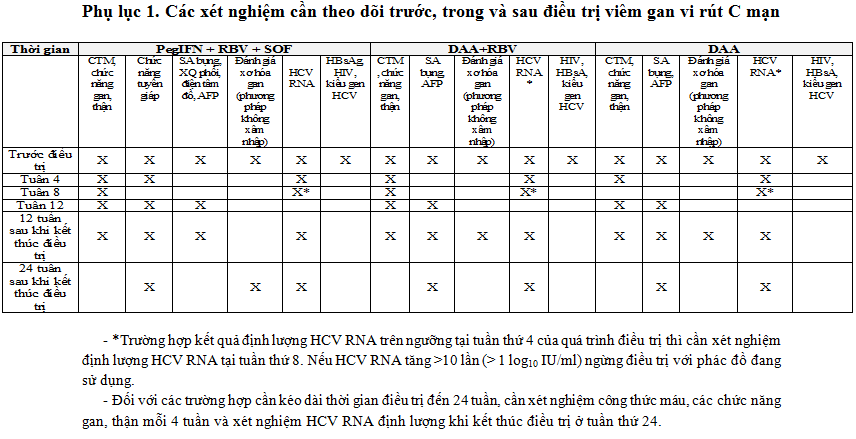
- ALT tăng ≥ 10 lần ở tuần thứ 4 điều trị DAAs. Nếu ALT tăng < 10 lần ở thời điểm này nhưng kèm theo bất kỳ tình trạng: suy nhược, buồn nôn - nôn, vàng da hoặc tăng có ý nghĩa Bilirubin, Phosphatase kiềm, INR nên xem xét ngưng điều trị. Nếu chỉ tăng ALT < 10 lần ở tuần thứ 4 điều trị DAAs, nên theo dõi sát và xét nghiệm ALT lập lại ở tuần điều trị thứ 6 và 8. Nếu tình trạng này không cải thiện thì xem xét ngưng điều trị.
- Trường hợp kết quả định lượng HCV RNA trên ngưỡng tại tuần thứ 4 của quá trình điều trị thì cần xét nghiệm định lượng HCV RNA tại tuần thứ 8. Nếu HCV RNA tăng >10 lần (> 1 log10 IU/ml) ngừng điều trị với phác đồ đang sử dụng. Cần hội chẩn với các chuyên gia để xem xét chuyển đổi phác đồ điều trị khác hiệu quả hơn.
- Đối với các trường hợp cần kéo dài thời gian điều trị đến 24 tuần, cần xét nghiệm công thức máu, các chức năng gan, thận mỗi 4 tuần và xét nghiệm HCV RNA định lượng khi kết thúc điều trị ở tuần thứ 24.
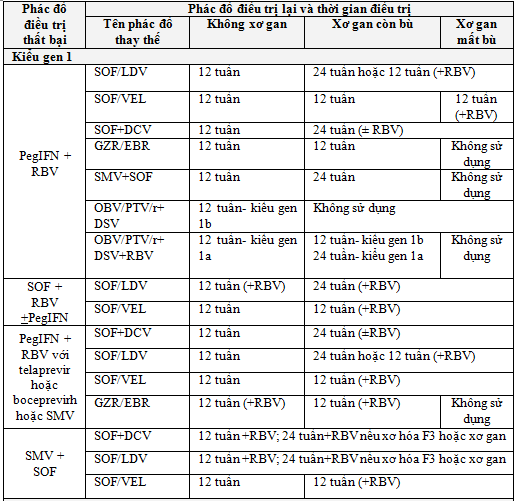
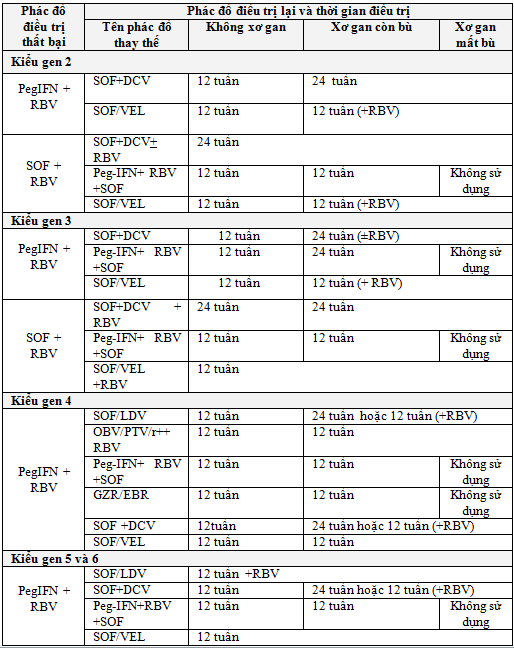
Lưu ý: Các trường hợp thất bại điều trị với các phác đồ chưa đề cập trong Bảng 6, việc lựa chọn phác đồ điều trị lại phải có ý kiến hội chẩn với chuyên gia trong từng trường hợp cụ thể.
Phụ lục 1. Các xét nghiệm cần theo dõi trước, trong và sau điều trị viêm gan vi rút C mạn