1. PHẢN ỨNG CÓ HẠI CỦA THUỐC (ADR):
A. Tổng kết công tác báo cáo ADR:
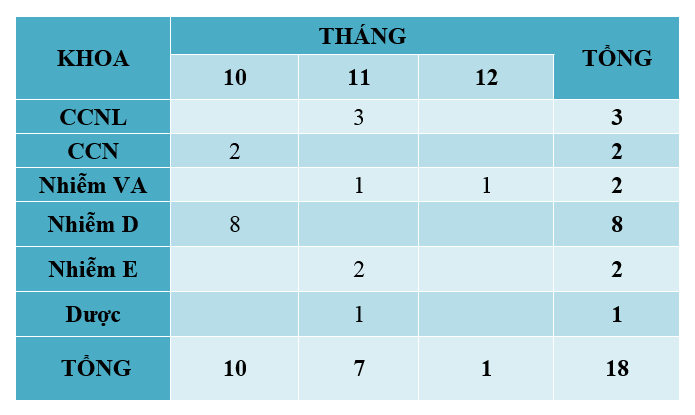
Quý 4-2021 ghi nhận có 18 báo cáo ADR xảy ra ở 6 khoa (Bảng 1). Trong đó khoa Nhiễm D nhiều nhất (8 ca), 1 ca đe dọa tử vong và 1 ca tử vong. So với Quý 3-2021 (11 báo cáo), số lượng báo cáo ADR Quý 4-2021 nhiều hơn đáng kể và có ca tử vong. Tuy nhiên, tổng số báo cáo trong năm 2021 là 77 giảm nhiều so với năm 2020 (132 ADR). Lý do, nhân viên y tế tập trung vào vấn đề điều trị dịch bệnh COVID-19, có ghi nhận các trường hợp có thể là ADR nhưng chưa xác định chắc chắn và không thực hiện báo cáo ADR. Dược lâm sàng chỉ hỗ trợ báo cáo trên Ehospital không trực tiếp đi lâm sàng nhằm tránh lây nhiễm nên hạn chế phần nào công tác báo cáo và ghi nhận ADR.
B. Phản hồi các khoa lâm sàng về chất lượng thuốc:
không có
2. THÔNG TIN THUỐC, CẢNH GIÁC DƯỢC:
Xin xem phần Thông tin thuốc
3. KHUYẾN CÁO DƯỢC LÂM SÀNG QUÝ 3-2021
3.1. Tổng kết công tác giám sát và can thiệp dược lâm sàng:
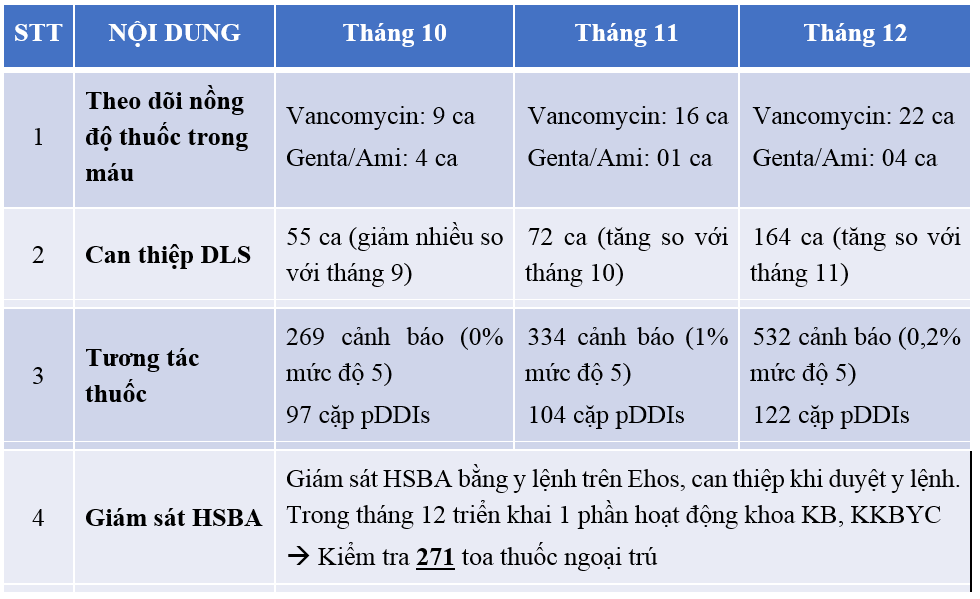
Do tình hình dịch Covid-19 bùng mạnh từ cuối tháng 5/2021, đơn vị DLS tạm dừng công tác kiểm HSBA và đi buồng tại các khoa lâm sàng nhằm hạn chế lây nhiễm; đến tháng 12 DSDLS bắt đầu hoạt động đi buồng trở lại. Trong Quý 4-2021, BV chủ yếu tiếp nhận bệnh COVID-19 nên số lượng bệnh giảm hẳn trong tháng 10, tháng 11 và tăng nhẹ trong tháng 12 do đó hoạt động can thiệp DLS cũng tăng đều từ tháng 10 -> 11 -> 12. (Bảng 3.1.)
DLS vẫn tiếp tục kịp thời hỗ trợ khá tốt công tác điều trị của các bác sĩ trong đợt dịch COVID-19 trong quý 4-2021 và hoạt động duyệt nội trú y lệnh được mở thêm cho 02 khu thoát hồi sức và khu nguy kịch tại Bệnh viện Dã chiến 3 tầng số 14 từ ngày 15/12/2021.
3.2. Kết quả cụ thể các hoạt động can thiệp DLS:
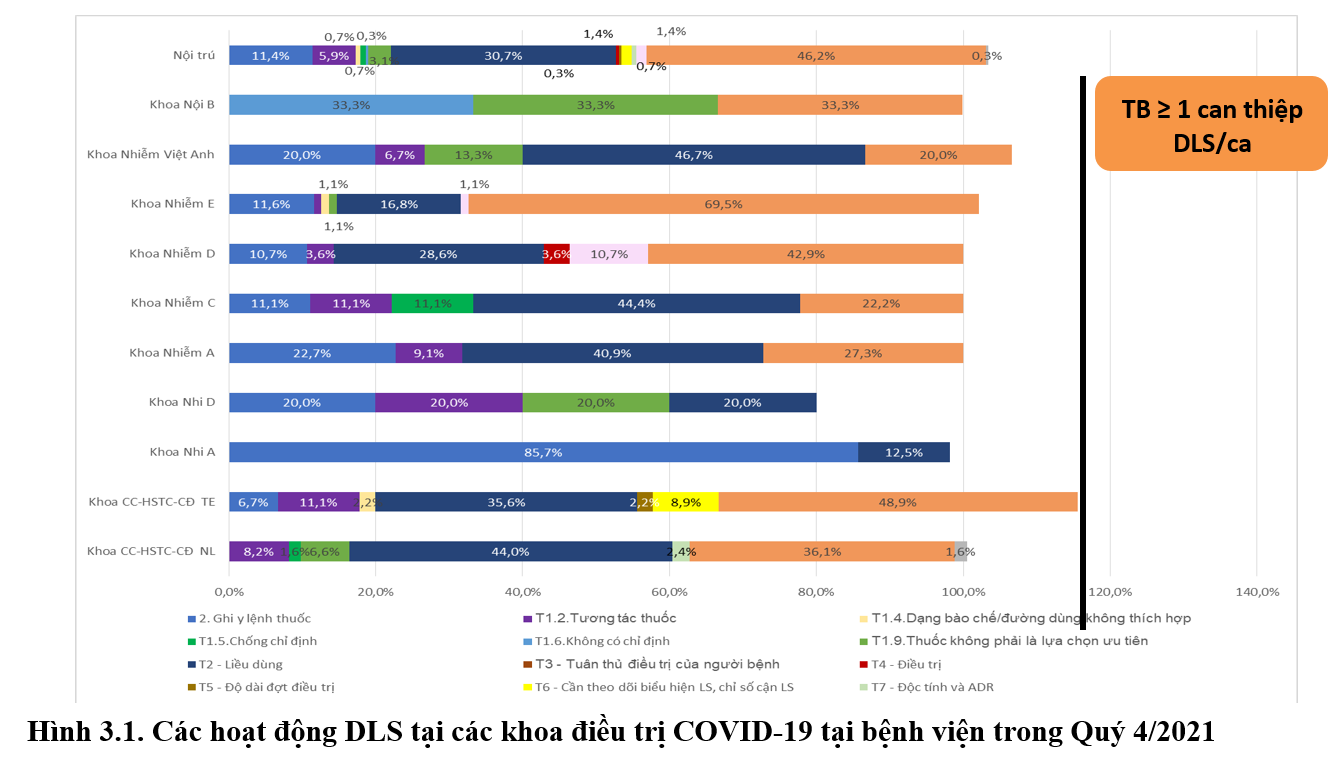
Các hoạt động DLS chủ yếu can thiệp về trong vấn đề về sử dụng thuốc: liều thuốc, theo dõi các chỉ số lâm sàng (SCr, CTM, AntiXa,…), tương tác thuốc, tác dụng không mong muốn của thuốc (remdesivir, caspofungin, HIT, cotrim,…). Bên cạnh đó, hoạt động tư vấn và hội ý trả lời câu hỏi của bác sĩ điều trị chiếm tỷ lệ cao 46% số can thiệp; chủ yếu về liều kháng sinh khi bệnh nhân suy thận, suy gan, CRRT và ECMO, TDM vancomycin và AG để đảm bảo an toàn-hiệu quả điều trị. Trong quý 4, bắt đầu hoạt động giám sát toa thuốc nhưng chưa ghi nhận cần can thiệp DLS.
Xét trong nội trú, kết quả cho thấy trung bình có hơn 1 can thiệp DLS trên một ca bệnh bao gồm tất cả các vấn đề liên quan đến ghi y lệnh và sử dụng thuốc. Các khoa LS khối lầu thường điều trị những ca COVID-19 từ nhẹ -trung bình và số lượng bệnh khá đông nên chủ yếu là sai sót trên y lệnh khi nhập máy vi tính và tất cả đã được chỉnh sửa khi duyệt y lệnh nội trú trước khi cấp phát cho các khoa, và một số trường hợp thuốc hàm lượng chưa có sẵn cần cung ứng do có những bệnh nhân Non-Covid bắt đầu nhập viện điều trị. Các khoa LS có giường hồi sức tích cực COVID-19 như Nhiễm E, CCNL chủ yếu can thiệp DLS hỗ trợ về liều thuốc, các trường hợp phối hợp/lựa chọn thuốc phù hợp với đối tượng người bệnh (ECMO, béo phì, PNCT,…) và hướng dẫn sử dụng các thuốc mới như Actemra, Casirivimab và Imdevimab, Micafungin, Favipiravir, Molnupiravir,… Khuyến cáo dược lâm sàng:
Quy chế kê đơn:
- Khi nạp y lệnh trên hệ thống HIS lưu ý kiểm tra y lệnh vì vẫn còn một số trường hợp lỗi trùng y lệnh hoặc đánh nhầm số lượng, tên thuốc; đặc biệt lưu ý khi choàng cử thuốc.
-> Rx Heparin lọ 25. 000UI/ 5ml, TDD dự phòng huyết khối; liều khuyến cáo 5. 000UI q12h ~ 0.2 lọ q12h -> Nhập thành 02 lọ q12h.
-> Rx Stadnex 20mg x 2 lần cho dự phòng loét DD, nhập choàng cử cho hôm sau -> Thường quên chỉnh lại vào ngày tiếp theo -> Y lệnh vẫn giữ Stadnex 20mg x 2 lần/ngày.
Liều:
- Nhiễm Klebsiella đa kháng nhạy colistin, fosfomycin :
-> Fosfomycin IV: 4g q6h (Theo Uptodate).
-> Khuyến cáo liều Fosfomycin thành 1g q8h để tăng hiệu quả và tránh hình thành kháng thuốc trong quá trình điều trị
-
Nhiễm Elizabethkinga menigoseptica: Cotrim 960mg: 3 – 4 viên/ngày. (Theo Sanford)
-
BN lớn tuổi, tăng huyết áp, đái tháo đường type 2, TD viêm phổi hít, Rx Imipenem 500 mg q6h. CN thận ClCr 16 ml/phút, Imipenem 500 mg q6h (ngày đầu), MD: 500 mg q8h.
-> ClCr < 15 ml/ph (Uptodate 2021, Sanford guide 2021) không nên dùng Imipenem
-> Khuyến cáo chỉnh liều Imipenem 500mg q12h với ClCr 15-30 ml/ph (Uptodate 2021) hoặc cân nhắc Meropenem
- BN theo dõi Gout đợt cấp đang Rx Meloxicam liều 7,5 mg q12h. CN thận CrCl =13 ml/phút
-> Meloxicam khuyến cáo tránh sử dụng khi GFR < 30 mL/phút (theo KDIGO, NSX)
-> Khuyến cáo dùng corticoid (VD methylprednisolon 24-32 mg/ngày chia 1-2 liều hoặc prednisolon 30-35 mg/ngày cho tới khi triệu chứng cải thiện, sau đó giảm dần liều trong vòng 7-10 ngày) (theo Uptodate, EULAR 2016)
-
Bệnh nhân viêm mô tế bào, sưng, đau, vết thương do kẽm đâm, Rx Meloxicam 7.5mg q12h
-
Bệnh nhân uốn ván, vết thương sưng đau. Rx Celecoxib 200mg q12h
-
BN (68kg, 170cm) COVID-19, suy hô hấp, viêm phổi, cấy BAL (16/12) ra C. albican đa nhạy -> Rx Fluconazole 900 mg/ngày
-> Khuyến cáo cân nhắc giảm liều Fluconazole: 450 mg/ngày (Uptodate 2021, nhiễm nấm xâm lấn)
- BN (80kg, 170cm) COVID-19 nguy kịch, sốc nhiễm trùng, cấy BAL (26/12) A. fumigatus -> Đề nghị Voriconazole. Hiện BN suy thận cấp tiến triển, tăng kali máu, tiểu 670 ml/ngày -> lọc máu CVVHDF. Lâm sàng diễn tiến xấu nhanh, BC tăng cao, vận mạch liều cao, tụt huyết áp.
-> BN lọc máu CVVHDF, nguy cơ tích lũy tá dược gây độc thận trong chế phẩm tiêm truyền (hiện không rõ tá dược này có lọc qua CRRT không), khuyến cáo Voriconazole uống hoặc thuốc kháng nấm khác (Uptodate 2021). Tuy nhiên lâm sàng diễn tiến nặng, Voriconazole uống không được tối ưu -> Cân nhắc LD Voriconazole IV, các ngày sau chuyển đường uống. Liều Voriconazole: LD 6 mg/kg (~400 mg) q12h, MD 4 mg/kg (~300mg) q12h (tính theo AdjBW 71 kg)
- BN xơ gan child C đang Rx domperidon liều 10 mg x 2 lần/ngày
-> Domperidone chống chỉ định ở BN suy gan trung bình-nặng -> Khuyến cáo ngưng Domperidon (Theo bộ y tế, uptodate)
Sử dụng thuốc:
-
Tác dụng gây suy tủy của các thuốc kháng nấm (tham khảo Uptodate, Medscap): giao động từ 1- 10%. Cân nhắc theo tính nguy cơ và lợi ích để sử dụng thuốc phù hợp với người bệnh.
-
Bệnh nhân COVID-19 sử dụng nhiều kháng sinh do đó cần theo dõi chức năng thận và gan thường quy, đặc biệt là khi phối hợp các thuốc như Colistin, vancomycin, piperacillin/tazobactam, cotrim, levofloxacin, teicoplanin, carbapenem.
-
Bé Viêm ống tai ngoài # Viêm tai giữa -> Augmentin 625mg x 3 lần/ngày
-> Khuyến cáo dùng chế phẩm dạng gói, có acid clavulanic thấp hơn, hạn chế tác dụng phụ của acid clavulanic cho bé.
- Bệnh nhân được kê Imidu (Isosorbid-5-mononitrat) 60mg 1 viên/ngày, cà nhuyễn qua sonde dạ dày -> Imidu 60mg là dạng phóng thích kéo dài -> cà nhuyễn mất tác dụng của dạng bào chế
-> Khuyến cáo: 1/2 viên 60mg x 2 lần/ngày để tránh gây hạ huyết áp.
- BN COVID-19 thai 23 tuần nghi ngờ nhiễm nấm Candida xâm lấn đang Rx Ampholip, ghi nhận giảm 2 dòng tế bào máu, trong đó bạch cầu hạt giảm nhiều nhất, nghi ngờ do ADR của Ampholip
-> Đổi thuốc kháng nấm. Theo Uptodate, tần suất ADR giảm các dòng tế bào máu của các thuốc kháng nấm như sau: Caspofungin (~10%), Micafungin mới ghi nhận trong RCT trên trẻ em (18%); Ampholip khoảng 5%
Cân nhắc chỉ định và thanh toán BHYT vì chỉ định trên KHÔNG CÓ TRONG TTSP đối với các thuốc sau:
-
Theo khuyến cáo NSX/DTQG 2018, Meloxicam chỉ định trong: Viêm khớp dạng thấp; Viêm cột sống dính khớp; Viêm khớp TE >=2 tuổi; Điều trị triệu chứng viêm xương khớp trầm trọng;
-
Theo khuyến cáo NSX (Cofidec), Celecoxib 200mg chỉ định trong: Viêm xương khớp; Viêm cột sống dính khớp; Viêm khớp dạng thấp
-
Fatig không nên dùng trong thời kỳ mang thai (Thuốc có thành phần tá dược Natri benzoat (phân nhóm C trên phụ nữ có thai theo FDA)
-> Khuyến cáo cân nhắc đổi sang chế phẩm Magdivix (Magnesi lactat, vitamin B6)
- Obimin là sản phẩm chuyên biệt dùng cho PNCT (Mua tiền mặt có Đề xuất đối tượng cụ thể).Bác sĩ kê cho đối tượng không phải PNCT -> Dùng 3B-MEDI TAB hoặc sắt đơn chất, Fatig,...
Lựa chọn thuốc điều trị nhiễm nấm xâm lấn ở đối tượng mang thai
-
Amphotericin B là lựa chọn được khuyến cáo sử dung cho PNCT (Uptodate 2021, IDSA 2016).
-
Nhóm Azole nên tránh sử dụng 3 tháng đầu thai kỳ. Voriconazol là chống chỉ định khi mang thai – liên quan đến dị tật thai nhi.
Cách dùng thuốc
Ketamin 50 mg/ml, lọ 10 ml:
• Truyền tĩnh mạch, pha với NaCl 0.9% hoặc glucose 5% thành nồng độ 1 mg/ml, thuốc ổn định trong vòng 24h (Thông tin sản phẩm).
• Liều dùng trong hỗ trợ thở máy ở ICU là IV bolus 0.1-0.5 mg/kg, duy trì TTM 0.2-0.5 mg/kg/h, điều chỉnh liều theo đáp ứng (khoảng liều 0.04-2.5 mg/kg/h) (Uptodate 2021).
• Tuy nhiên, với nồng độ 1 mg/ml, thể tích dịch quá nhiều, có thể quá tải dịch -> cân nhắc pha thành nồng độ 10 mg/ml (Injectable drug guide 2011, Minimum volume 2012 khuyến cáo có thể pha đậm đặc đến 50 mg/ml), tuy nhiên chưa rõ thời gian ổn định của thuốc -> Khuyến cáo theo dõi dung dịch thuốc đã pha, nếu có bất thường thì NGƯNG TRUYỀN.
Tương tác thuốc:
-
Trong Quý 4-2021, 1135 pDDIs cảnh báo trên hệ thống duyệt y lệnh nội trú. Số lượng cảnh báo giảm rõ so với quý 3-2021 (1975 pDDIs) do số lượng bệnh nhân COVID-19 nặng giảm mạnh sau tháng 7-9/2021.
-
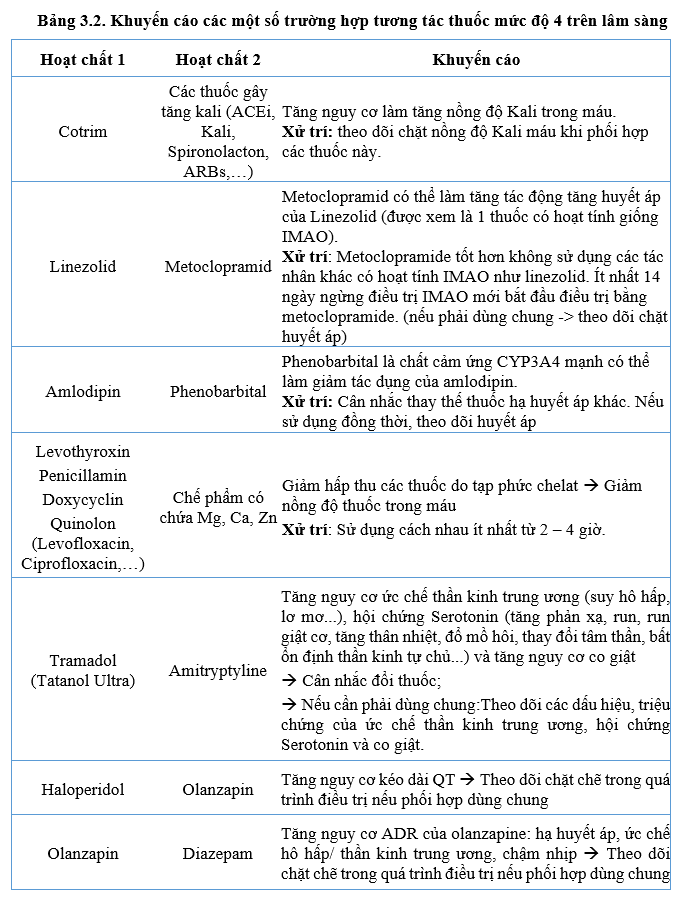
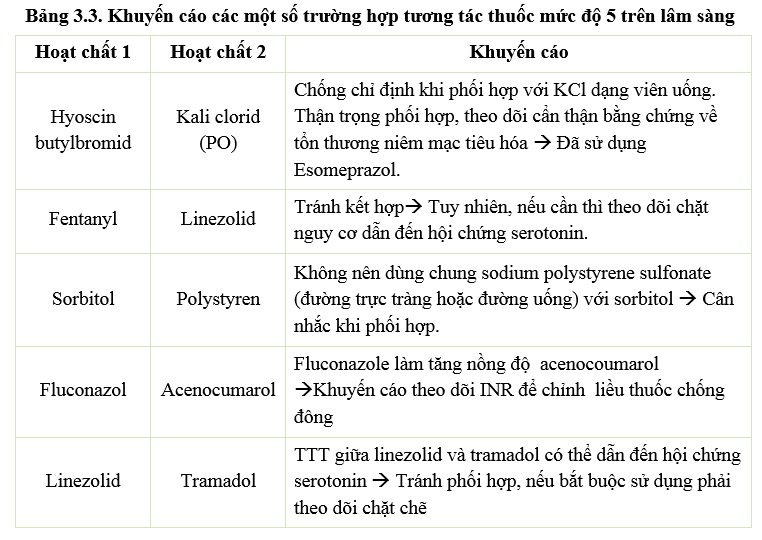
Các pDDI mức độ 4 – 5 cũng tăng so với quý 3-2021 và có một số tương tác mới cần lưu ý và thận trọng trong điều trị (Bảng 3.2 và 3.3)

4. CHUYÊN ĐỀ: HIỆU QUẢ CỦA TOCILIZUMAB TRONG ĐIỀU TRỊ COVID-19
4.1. TỔNG QUAN
Interleukin-6 (IL-6) là một cytokine tiền viêm toàn thân được sản xuất bởi nhiều loại tế bào, bao gồm: tế bào lympho, bạch cầu đơn nhân và nguyên bào sợi. Hội chứng hô hấp cấp nghiêm trọng (ARDS) liên quan đến coronavirus (SARS-CoV) gây cảm ứng sản xuất IL-6 phụ thuộc nồng độ từ các tế bào biểu mô phế quản. Đáp ứng viêm hệ thống do COVID-19 và suy hô hấp thiếu oxy có thể dẫn đến việc phóng thích cytokine tăng cao, biểu hiện bởi sự gia tăng nồng độ IL-6, protein C phản ứng (CRP), D-dimer và ferritin1–4

Một giả thuyết đặt ra là việc điều chỉnh mức nồng độ IL-6 hoặc tác động của nó có thể làm giảm thời gian và/hoặc mức độ nghiêm trọng của bệnh COVID-19. Có hai nhóm chất ức chế IL-6 được Cơ quan Quản lý Thực phẩm và Dược phẩm Mỹ (FDA) phê duyệt gồm: Kháng thể đơn dòng kháng thụ thể IL-6 (ví dụ: sarilumab, tocilizumab) và kháng thể đơn dòng kháng IL-6 (ví dụ: siltuximab). Những loại thuốc này đã được đánh giá để sử dụng ở bệnh nhân mắc COVID-19 có phản ứng viêm hệ thống(1,5).
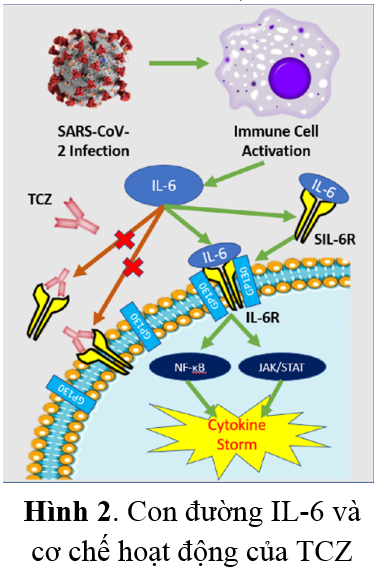
Tocilizumab (TCZ) là một kháng thể đơn dòng tái tổ hợp với miền biến đổi từ chuột và miền không đổi IgG1 của người. TCZ liên kết với cả thụ thể IL-6 hòa tan và liên kết màng, do đó ngăn cản quá trình truyền tín hiệu qua trung gian IL-6 (Hình 2). Ban đầu thuốc được phát triển để điều trị bệnh viêm khớp dạng thấp và hiện tại được chấp thuận cho điều trị bệnh viêm động mạch tế bào khổng lồ và các bệnh tự miễn dịch tương tự(5,6).
Tổng hợp các nghiên cứu đánh giá hiệu quả của TCZ trong điều trị COVID-19 năm 2020 được ghi nhận theo Bảng 16
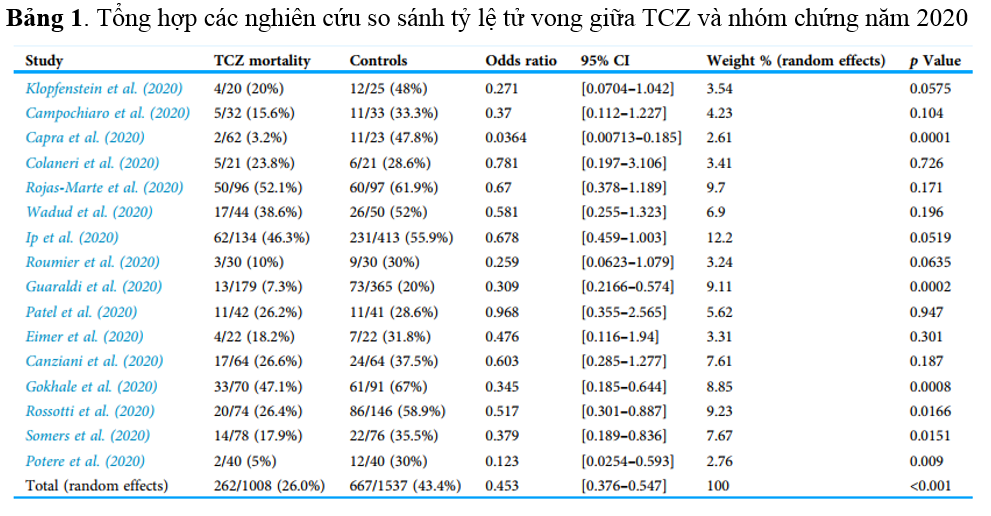
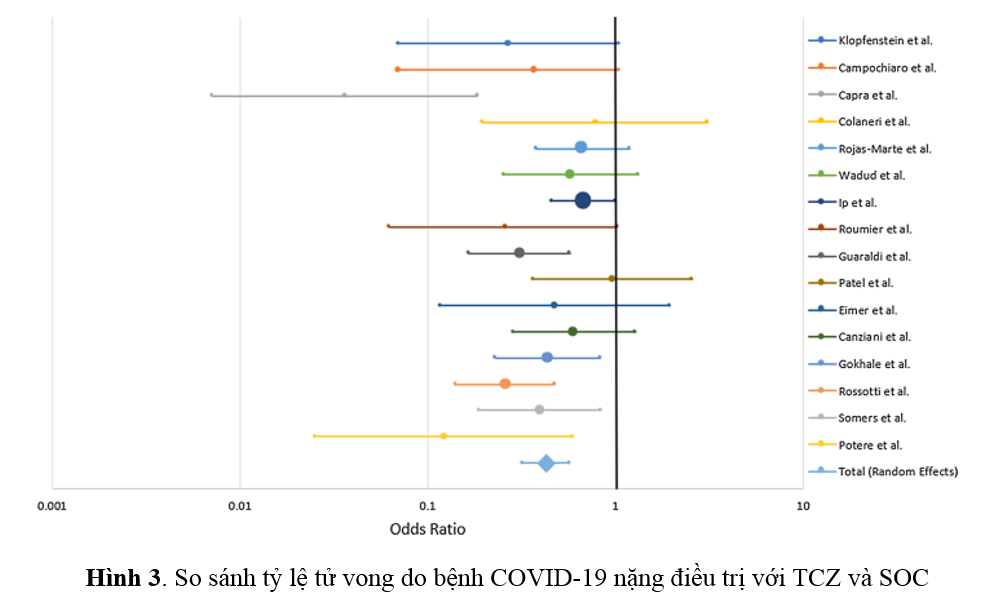
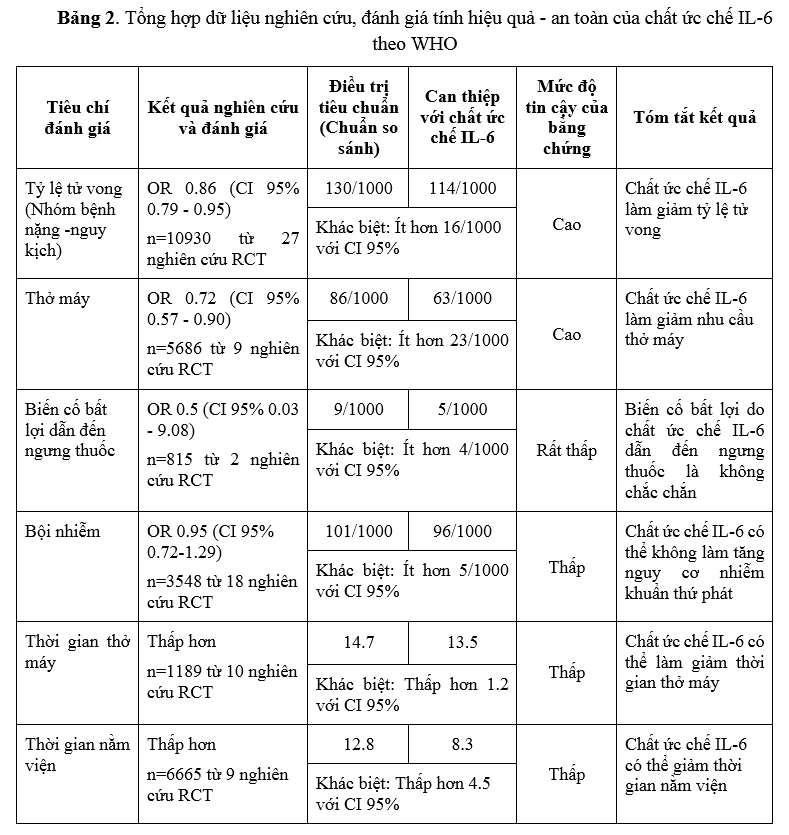
Theo Bảng 1, tỷ lệ tử vong với nhóm được điều trị bằng TCZ và nhóm điều trị tiêu chuẩn (SOC) lần lượt là 26.0% và 43.4%. Tất cả các nghiên cứu đều cho thấy có xu hướng giảm tỷ lệ tử vong do COVID-19 ở những bệnh nhân nặng được điều trị bằng TCZ so với SOC, ngoại trừ nghiên cứu của Patel và cộng sự (2020) cho thấy không mang lại lợi ích gì (Hình 3)(6)
Một nghiên cứu quan sát, hồi cứu gồm những bệnh nhân bị viêm phổi COVID-19 nặng với tình trạng thiếu oxy kéo dài (được định nghĩa là SpO2 ≤ 94% hoặc cần bổ sung oxy ≤ 15 L/phút qua mask hoặc tỷ lệ PaO2/FiO2 dưới 200) nhập viện đến một trung tâm chăm sóc cấp ba ở Mumbai, Ấn Độ từ 31 tháng 3 đến ngày 5 tháng 7 năm 2020.
Theo nghiên cứu này, ngoài những điều trị tiêu chuẩn, 151 bệnh nhân đã được tiêm tĩnh mạch một liều đơn TCZ 400 mg. Phân tích hồi quy Cox đơn biến và đa biến được thực hiện trên 151 bệnh nhân để xác định các yếu tố dự báo khả năng sống sót. Kết quả cho thấy: Trong số 269 bệnh nhân (151 ở nhóm TCZ và 118 nhóm chứng) được nghiên cứu, thời gian sống thêm trung bình ở nhóm TCZ dài hơn đáng kể so với nhóm chứng; 18 ngày (95% CI, 11.3-24.7) so với 9 ngày (95% CI, 5.7-12.3), p=0.007. Trên phân tích hồi quy Cox đa biến, các yếu tố dự báo độc lập về khả năng sống sót ở bệnh nhân COVID-19 là việc sử dụng TCZ (HR 0.621, 95% CI 0.427–0.903, p=0.013) và độ bão hòa oxy cao hơn(7).
Một nghiên cứu bệnh-chứng, hồi cứu, đa trung tâm chỉ ra rằng TCZ có hiệu quả trong điều trị ở những bệnh nhân nhập viện do COVID-19 dùng đồng thời hoặc không với SOC. Kết cục chính là tiến triển dẫn đến đặt nội khí quản hoặc tử vong. Mô hình hồi quy logistic cho thấy TCZ làm giảm đáng kể tình trạng đặt nội khí quản hoặc tử vong (OR 0.40, p = 0.0017). Khi xét riêng tiêu chí đặt nội khí quản, những người sử dụng TCZ đã giảm được > 60% tỷ lệ đặt nội khí quản(3).
Thử nghiệm REMAP-CAP và RECOVERY, hai thử nghiệm TCZ ngẫu nhiên có đối chứng lớn nhất được thực hiện cho đến nay, đều báo cáo lợi ích giảm tỷ lê tử vong của TCZ ở những bệnh nhân mất bù hô hấp nhanh, những người cần cung cấp oxy qua HFNC hoặc thông khí không xâm lấn. Corticosteroid được dùng cho đa số bệnh nhân trong cả hai nghiên cứu(1,8).
Theo nghiên cứu REMAP-CAP, tiêu chuẩn thu nhận bệnh nhân điều trị TCZ tương đối hẹp: Bệnh nhân được đưa vào ICU trong vòng 24h do COVID-19 từ nặng đến nguy kịch và có biểu hiện mất bù hô hấp nhanh chóng được chọn ngẫu nhiên nhãn mở (open label) để tiếp nhận điều trị với hoặc TCZ+SOC (n=353) hoặc sarilumab+SOC (n=48) hoặc SOC (n=402). Thời gian trung bình tính từ lúc nhập viện đến khi tiếp nhận điều trị là 1.2 ngày (IQR 0.8–2.8 ngày) và kể từ khi nhập vào ICU là 13.6 giờ. Mức oxy ban đầu: 28.8% HFNC, 41.5% thở máy không xâm lấn, 29.4% khi thở máy. Corticosteroid dùng đồng thời ở 90% bệnh nhân. Kết quả: So với SOC, việc sử dụng TCZ làm giảm tỷ lệ tử vong khi nhập viện (28% so với 36%) và tăng số ngày không cần hỗ trợ hô hấp và tim mạch (10 ngày so với 0 ngày; OR 1.64; CI 95%, 1.25–2.14). Tỷ lệ bệnh nhân ban đầu không thở máy tiến triển đến đặt nội khí quản hoặc tử vong: 41.3% ở nhóm TCZ so với 52.7% ở nhóm SOC. Việc tiếp nhận điều trị diễn ra trong vòng 24 giờ sau khi nhập vào ICU và thời gian trung bình tiếp nhận điều trị kể từ khi nhập viện là 1.2 ngày cho thấy lợi ích của TCZ hiệu quả đặc biệt ở những bệnh nhân đang bị mất bù hô hấp nhanh chóng. Trong REMAP-CAP, bằng chứng về lợi ích điều trị mạnh nhất ở những bệnh nhân mới bắt đầu bổ sung oxy thông qua HFNC hoặc thông khí không xâm lấn. Những hạn chế của nghiên cứu: Nhãn mở, việc thu thập các biến cố bất lợi (adverse events) bị hạn chế, phần lớn (72%) là người da trắng1,8. Thử nghiệm RECOVERY cũng gợi ý lợi ích về việc giảm tỷ lệ tử vong khi điều trị TCZ khi phối hợp với dexamethasone ở những bệnh nhân yêu cầu thông khí không xâm lấn hoặc HFNC. Trong nghiên cứu này, một nhóm nhỏ những người tham gia bị giảm oxy máu (SpO2 ≤ 92%) và mức CRP ≥75 mg/L được đề nghị tham gia ngẫu nhiên nhãn mở để tiếp nhận TCZ (n=2022) hoặc SOC (n=2094). Thời gian trung bình từ khi nhập viện cho đến khi tiếp nhận điều trị là 2 ngày (IQR 1–5 ngày). CRP trung bình 143 mg/L (IQR 107–204 mg/L). Mức oxy ban đầu: ghi nhận 45% được thở oxy thông thường, 41% khi thở HFNC/không xâm lấn và 14% thở máy; 82% người tham gia đang dùng đồng thời corticosteroid. Kết cục chính, TCZ làm giảm tỷ lệ tử vong do mọi nguyên nhân; tỷ lệ tử vong vào ngày 28 ở nhóm TCZ thấp hơn so với nhóm SOC (29% so với 33%; tỷ lệ 0.86; CI 95%, 0.77–0.96). Phân tích chi tiết: Trong số những bệnh nhân cần thở máy lúc đầu, tỷ lệ tử vong vào ngày 28 tương tự ở nhóm TCZ và nhóm SOC (47% so với 48%). Kết cục phụ: Tỷ lệ bệnh nhân sống sót xuất viện trong vòng 28 ngày ở nhóm TCZ cao hơn nhóm SOC (54% so với 47%; tỷ lệ 1.22; CI 95%, 1.12–1.34). Trong số những bệnh nhân không thở máy lúc đầu, bệnh nhân diễn tiến thở máy hoặc tử vong ở nhóm dùng TCZ thấp hơn so với SOC (33% so với 38%; RR 0.85; CI 95%, 0.78–0.93). Những hạn chế của nghiên cứu ngày gồm: Nhãn mở, việc thu thập các biến cố bất lợi bị hạn chế, phần lớn (68%) là người da trắng (số ít các chủng tộc khác), khó khăn cho việc lựa chọn chính xác bệnh nhân để tiến hành một nghiên cứu RECOVERY đoàn hệ; tùy ý chọn ngưỡng (cut off) CRP ≥75 mg /L (1,8).
Bên cạnh hai thử nghiệm kể trên, thử nghiệm COVACTA lại cho kết quả không có sự khác biệt giữa TCZ và giả dược theo kết cục chính là tình trạng lâm sàng (thang điểm 7) vào ngày 28 nhưng TCZ đã chứng minh thời gian khôi phục và thời gian nằm ICU ngắn hơn (kết cục phụ). Trong khi đó, nghiên cứu TOCIBRAS phải dừng lại sớm vì nguy cơ tử vong tăng trong nhóm TCZ ở ngày thứ 15: 16.9% so với 3.1% ở SOC (OR 6.42; 95% CI, 1.59–43.2)(1).
Một nghiên cứu đánh giá hệ thống (systematic review) và phân tích tổng hợp (meta-analysis) lấy dữ liệu từ 8 nghiên cứu thử nghiệm ngẫu nhiên có đối chứng (RCT) với 6481 bệnh nhân bị nhiễm COVID-19 nặng, không nguy kịch ở người trưởng thành, so sánh TCZ với giả dược/nhóm chứng đã được tiến hành ở Isarel và xuất bản 19/05/2021. Nghiên cứu cho kết quả: TCZ có liên quan đến việc giảm tỷ lệ tử vong do mọi nguyên nhân trong 28–30 ngày so với giả dược/nhóm chứng (RR 0.89, 95% CI 0.82–0.96). Trong số phân nhóm bệnh nhân nguy kịch, tỷ lệ tử vong không giảm (RR 0.94, 95% CI 0.74–1.19). TCZ có liên quan đến việc giảm đáng kể nguy cơ thở máy (MV); hoặc kết hợp kết cục cuối cùng là tử vong hoặc MV và nhập viện vào ICU. Không có sự khác biệt đáng kể về các tác dụng phụ. Nguy cơ bội nhiễm nghiêm trọng thấp hơn đáng kể với TCZ (RR 0.57, 95% CI 0.35–0.93)(9).
Theo hướng dẫn cập nhật đến ngày 06/07/2021, Tổ chức Y tế thế giới (WHO) khuyến cáo nên điều trị với chất ức chế IL-6 (tocilizumab hoặc sarilumab) cho bệnh nhân bị nhiễm COVID-19 nặng hoặc nghiêm trọng. Cũng theo hướng dẫn này, ở những bệnh nhân nặng-nguy kịch, khuyến cáo sử dụng phối hợp corticoid và chất ức chế IL-6. Chất ức chế thụ thể IL-6 làm giảm tỷ lệ tử vong và nhu cầu thở máy dựa trên bằng chứng với độ tin cậy cao. Mặt khác, chất ức chế IL-6 có thể có hiệu quả trong việc giảm thời gian thở máy và nằm viện, tuy mức độ tin cậy bằng chứng thấp do nhiễu (bias) lớn, thiếu mù (blinding). Tóm tắt tính hiệu quả-an toàn của chất ức chế IL-6 được cho như Bảng 2 (8).
4.2. ĐẶT VẤN ĐỀ
Qua phân tích dữ liệu từ các nghiên cứu, việc chỉ định TCZ chủ yếu dựa trên đánh giá mức độ nặng của bệnh nhân COVID-19 theo nhu cầu oxy (trừ nghiên cứu RECOVERY với mức CRP ≥ 75mg/L). Việc kết hợp thêm xét nghiệm các chỉ số gia tăng trong đáp ứng viêm ở bệnh nhân COVID-19 như: CRP, IL-6, ferritin, D-dimer, LDH, bạch cầu, lympho,... có thể hữu ích trong việc xác định chính xác thời điểm dùng TCZ, tránh nguy cơ chỉ định quá sớm (không cần thiết, gia tăng nguy cơ bội nhiễm) hoặc quá muộn (hiệu quả không tối ưu dẫn đến diễn tiến “cơn bão cytokine-Cytokine storm-CS”).
Ruan và cộng sự đã phân tích sự khác biệt về tỷ lệ tử vong giữa hai phân nhóm nhiễm COVID-19; nhóm xuất viện và nhóm tử vong. Nhóm tác giả quan sát thấy có sự khác biệt đáng kể về số lượng tế bào bạch cầu, CRP và IL-6 giữa 2 nhóm và kết luận rằng tỷ lệ tử vong do COVID-19 có thể là do CS liên quan đến virus. Chen và cộng sự đánh giá sự khác biệt giữa bệnh nhân COVID-19 nặng và trung bình. Số lượng tế bào bạch cầu lympho thấp hơn đáng kể trong các trường hợp bệnh nghiêm trọng (số lượng tế bào lympho <0.8×109/L) trong khi mức LDH, CRP và D-dimer cao hơn rõ rệt trong các trường hợp nặng so với các trường hợp trung bình (10).
Một phân tích tổng hợp của Zheng và cộng sự kết luận rằng LDH >245 U/L và D-dimer >0.5 mg/L dự đoán diễn tiến nặng ở bệnh nhân COVID-19. Zhou và cộng sự báo cáo rằng D-dimer >1000 mg/mL khi nhập viện có liên quan đến việc tăng nguy cơ tử vong trong bệnh viện11. Ibanez và cộng sự báo cáo trong một nghiên cứu tiến cứu cho rằng mức D-dimer trung bình ở bệnh nhân COVID-19 nhập viện ICU là 1000 ng/mL(12).
Mối tương quan giữa mức CRP tăng cao và mức độ nghiêm trọng của bệnh COVID-19 đã được chứng minh, cũng như sự kết hợp giữa giảm bạch cầu lympho và nồng độ CRP cao như là một dấu hiệu của nhiễm trùng nặng. Wang và cộng sự báo cáo rằng CRP là yếu tố dự báo quan trọng nhất cho tỷ lệ tử vong ở bệnh nhân COVID-19 (13,14).
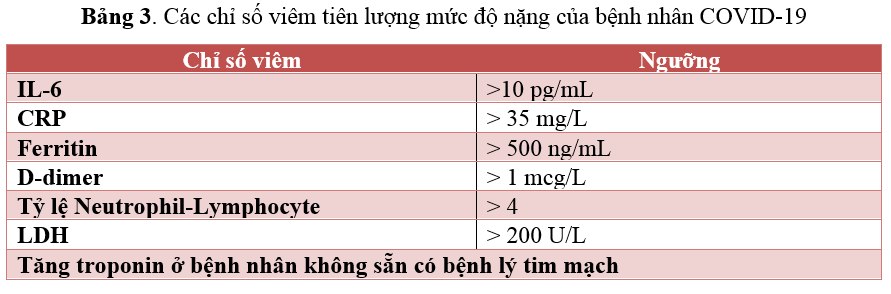
Huang và cộng sự (2021), trong một nghiên cứu quan sát hồi cứu, bệnh nhân được chẩn đoán COVID-19 sẽ được tiến hành các xét nghiệm: mức IL-6 huyết thanh, CRP, ferritin, D-dimer, lactate dehydrogenase (LDH) và troponin I. Bệnh nhân được chỉ định điều trị với TCZ theo các tiêu chí sau:
-
Dấu hiệu tổn thương hô hấp bao gồm: thở nhanh, khó thở hoặc;
-
Độ bão hòa oxy mao mạch ngoại vi SpO2 <90% với ít nhất 4L oxy bổ sung hoặc;
-
Tăng nhu cầu oxy trong 24 giờ;
Cộng 2 hoặc nhiều yếu tố tiên lượng cho bệnh nặng theo như Bảng 3. Kết quả cho thấy điều trị bằng TCZ có liên quan đến tỷ lệ tử vong ít hơn so với không điều trị với TCZ (15).
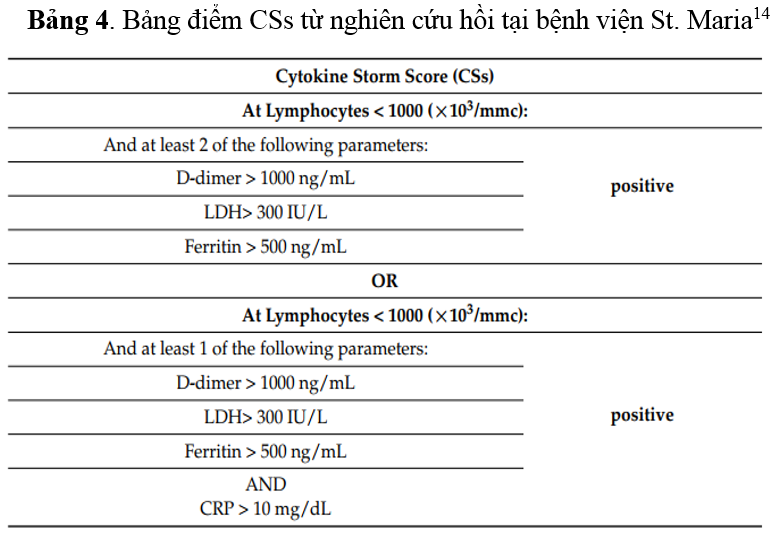
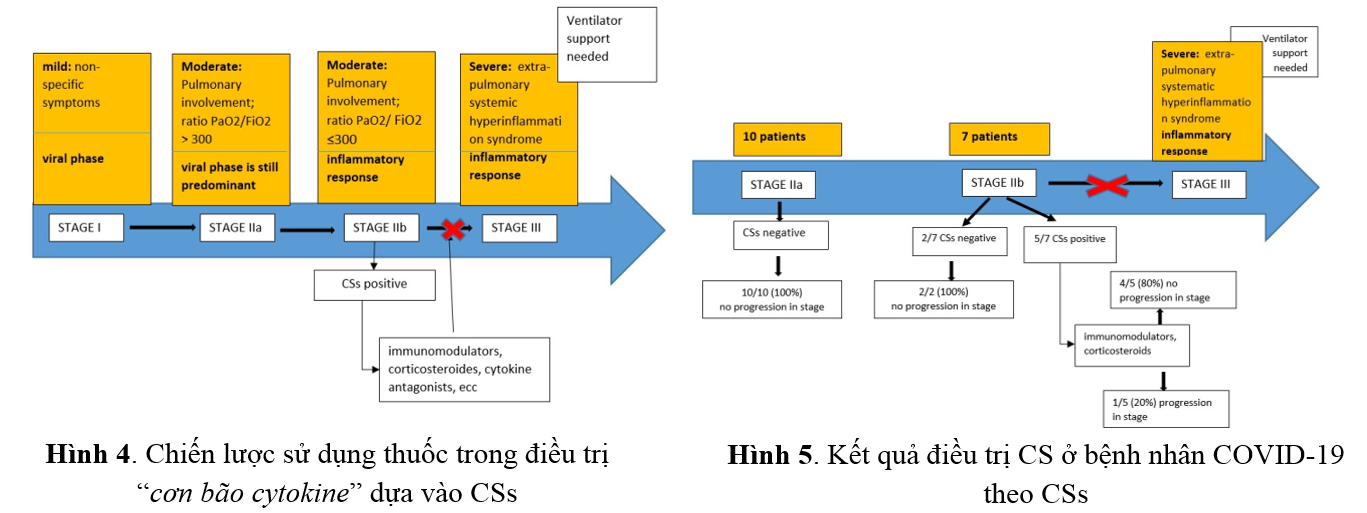
Một nghiên cứu hồi cứu trên 31 bệnh nhân nhập viện Khoa Truyền nhiễm tại Bệnh viện "St. Maria" ở Terni với các trường hợp nhiễm SARS-CoV-2 đã được ghi nhận và phân tích “điểm cơn bão cytokine” (Cytokine storm score - CSs) với mức độ nặng của bệnh nhân COVID-19. Đây là nghiên cứu đầu tiên đề xuất và áp dụng thang điểm mới (Bảng 4) nhằm nhanh chóng xác định bệnh nhân COVID-19 đang ở giai đoạn đầu của CS, từ đó quyết định sử dụng thuốc điều hòa miễn dịch, corticosteroid và thuốc đối kháng cytokine kịp thời, an toàn và hiệu quả, nhằm ngăn ngừa bệnh tiến triển nặng và giảm tỷ lệ tử vong (Hình 4)(14)
Cũng theo nghiên cứu này, sau khi thiết lập CSs từ hồi cứu 31 bệnh nhân, nhóm tác giả tiến hành nghiên cứu tiến cứu trên 17 bệnh nhân và sử dụng thang điểm CSs để đánh giá nguy cơ CS. Theo đó, ghi nhận 80% (4/5) bệnh nhân có CS dương tính (Hình 5), được dùng TCZ và/hoặc dexamethasone không có tiến triển nặng giai đoạn sau. Nghiên cứu này phải dừng lại sớm do cơ quan quản lý dược phẩm Italia (AIFA) thông qua một nghiên cứu cho thấy TCZ không có đủ bằng chứng hiệu quả trên lâm sàng(14)
Tại Việt Nam, Quyết định số 4689/QĐ-BYT ngày 06/10/2021 do Bộ Y tế ban hành, bảng điểm đánh giá nguy cơ “cơn bão cytokine” đã được đề cập trong Hướng dẫn chẩn đoán và điều trị COVID-19 (Bảng 5).
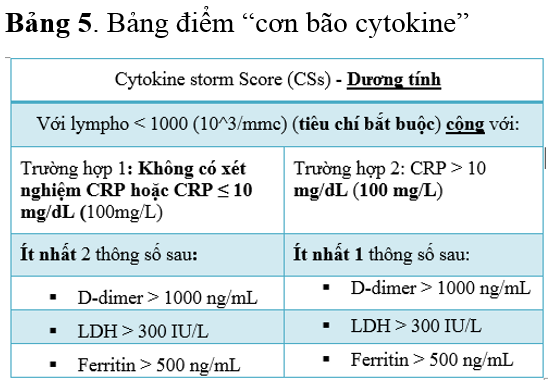
Từ các nghiên cứu trên cho thấy thời điểm điều trị là rất quan trọng đối với bệnh nhân COVID-19 có khả năng diễn tiến vào “cơn bão cytokine” và CSs có thể là một công cụ hỗ trợ hiệu quả trong việc đánh giá chính xác thời điểm dùng thuốc. Sử dụng đúng thời điểm chất đối kháng thụ thể IL-6, corticosteroid, chất ức chế Janus kinase (JAK), và thuốc chẹn TNF sẽ kịp thời khóa cơ chế khơi mào đáp ứng miễn dịch của cơ thể, ngăn tiến triển đến giai đoạn nặng về sau. Ngược lại, có thể dẫn đến kết cục xấu hơn, chẳng hạn như phải đặt nội khí quản hoặc thở máy (14).
4.3. KHUYẾN CÁO SỬ DỤNG TOCILIZUMAB TRONG COVID-19
Theo Hướng dẫn điều trị COVID-19 của NIH (National Institutes of Health) (cập nhất đến ngày 17/06/2021), WHO (cập nhật đến ngày 06/07/2021), Hiệp hội các bệnh truyền nhiễm Hoa Kỳ (IDSA) (cập nhật đến ngày 27/10/2021), khuyến cáo về việc sử dụng chất ức chế IL-6 ở bệnh nhân COVID-19 (dựa trên dữ liệu lâm sàng chính từ 2 nghiên cứu REMAP-CAP và RECOVERY) được mô tả như sau(1,8,16):
- TCZ IV liều duy nhất 8mg/kg tính theo cân nặng thật (ABW), có thể lên đến 800mg; kết hợp với dexamethasone 6mg/ngày (có thể tăng đến 10mg/ngày) ở bệnh nhân nhập viện đang có biểu hiện mất bù hô hấp nhanh chóng do COVID-19. Tiêu chí sử dụng gồm:
Những bệnh nhân nhập viện trong vòng 3 ngày, đã được đưa vào ICU trong vòng 24 giờ trước đó và những bệnh nhân này cần thở máy xâm lấn, thông khí không xâm lấn hoặc oxy mũi qua canula dòng cao (HFNC) >0,4 FiO2/oxy 30 L/phút (BIIa); hoặc
Những bệnh nhân nhập viện trong vòng 3 ngày, không vào ICU nhưng có nhu cầu oxy tăng nhanh và cần thông khí không xâm lấn hoặc HFNC và có dấu hiệu viêm tăng đáng kể (CRP ≥75 mg/L) (BIIa).
-
Đối với những bệnh nhân nhập viện với tình trạng giảm oxy máu chỉ cần điều trị oxy thông thường (chưa cần thông khí không xâm lấn hoặc HFNC như đã mô tả ở trên), không có đủ bằng chứng để xác định những đối tượng bệnh nhân nào trong số nhóm bệnh nhân này sẽ được lợi khi bổ sung TCZ. Một số thành viên Ban Hội thẩm khuyến cáo dùng TCZ cho những bệnh nhân có biểu hiện tăng nhanh nhu cầu oxy khi đang điều trị với dexamethasone và có CRP ≥75 mg/L.
-
TCZ nên tránh dùng ở những bệnh nhân bị ức chế miễn dịch đáng kể, đặc biệt ở những bệnh nhân mới sử dụng các thuốc điều hòa miễn dịch sinh học khác và ở những bệnh nhân có alanin aminotransferase >5 lần giới hạn bình thường trên; nguy cơ cao cho các đối tượng bị thủng đường tiêu hóa; nhiễm khuẩn, nấm hoặc virus không phải SARS-CoV-2 nghiêm trọng không kiểm soát được; số lượng bạch cầu trung tính <500 tế bào/µL; số lượng tiểu cầu <50.000 tế bào/µL; hoặc đã biết quá mẫn cảm với tocilizumab.
-
TCZ chỉ nên được dùng kết hợp với liệu trình dexamethasone (hoặc corticosteroid thay thế với liều tương đương với dexamethasone 6 mg). Một số chuyên gia khuyến cáo có thể đánh giá đáp ứng lâm sàng của bệnh nhân với dexamethasone trước khi cân nhắc quyết định có cần dùng tocilizumab hay không.
-
Mặc dù một số bệnh nhân trong nghiên cứu REMAP-CAP và RECOVERY đã nhận được liều TCZ thứ hai theo chỉ định của bác sĩ điều trị, tuy nhiên không có đủ dữ liệu để chỉ ra những đối tượng bệnh nhân nào sẽ được lợi khi dùng thêm một liều TCZ.
-
Các trường hợp nhiễm giun lươn nặng và lan tỏa đã được báo cáo khi sử dụng TCZ và corticosteroid ở bệnh nhân COVID-19. Điều trị dự phòng bằng ivermectin nên được được cân nhắc cho những bệnh nhân đến từ các vùng lưu hành bệnh giun lươn.
Cũng theo Quyết định số 4689/QĐ-BYT, trong điều trị chống “cơn bão cytokine”, bệnh nhân được khởi trị với corticoid (tăng liều khi có dấu hiệu bệnh chuyển nặng). Theo dõi đáp ứng điều trị (triệu chứng lâm sàng, chỉ số viêm,...), nếu không cải thiện, phối hợp chất ức chế IL-6, lọc máu. Theo Bộ y tế, TCZ được khuyến cáo sử dụng như Bảng 6(17).
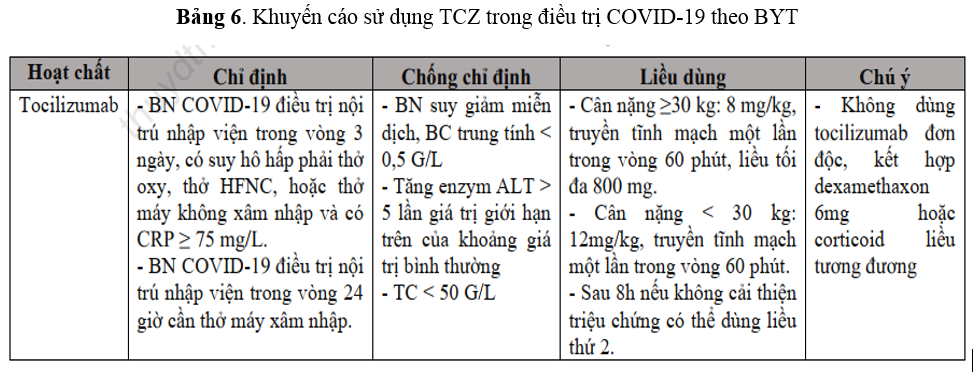
Khuyến cáo sử dụng TCZ theo Quyết định số 4689/QĐ-BYT của Bộ y tế cũng tương tự như khuyến cáo của NIH, WHO và IDSA. Tóm tắt khuyến cáo của TCZ được cho như Bảng 7.

4.4. TOCILIZIMUB TRONG THỰC HÀNH LÂM SÀNG ĐIỀU TRỊ COVID-19
Trong điều trị COVID-19 tại Bệnh viện Bệnh Nhiệt đới (BV BNĐ), ngoài các thuốc trong liệu pháp điều trị tiêu chuẩn như corticoid, kháng đông, kháng sinh, kháng nấm khi có bội nhiễm. Tocilizumab (biệt dược Actemra)5 còn được các bác sĩ lâm sàng cân nhắc chỉ định trong trường hợp bệnh nhân có diễn tiến nặng có thể dẫn đến “cơn bão cytokine”. Việc chỉ định được thông qua Hội đồng điều trị COVID-19 TP.HCM. Tuy nhiên, trước Quyết định số 4689/QĐ-BYT ban hành ngày 06/10/2021, nguy cơ diễn tiến “cơn bão cytokine” chủ yếu dựa trên đánh giá diễn lâm sàng của bác sĩ điều trị và ý kiến chuyên gia trong Hội đồng điều trị COVID-19 TP.HCM. Việc thiếu một bảng điểm đánh giá nguy cơ rõ ràng như CSs có thể dẫn đến thời điểm dùng thuốc chưa thật sự hợp lý. Quyết định số 4689/QĐ-BYT hướng dẫn điều trị “cơn não cytokine” được khởi đầu khi bệnh có dấu hiệu chuyển nặng với việc tăng liều corticoid (liều cao duy trì <7 ngày). Đồng thời, theo dõi đáp ứng lâm sàng và các chỉ số viêm như CRP, IL-6, LDH, ferritin,... nếu không cải thiện, phối hợp chất ức chế IL-6, lọc máu. Tuy Quyết định số 4689/QĐ-BYT đã có hướng dẫn đánh giá điểm nguy cơ “cơn bão cytokine” nhưng chưa hướng dẫn cụ thể việc sử dụng bảng điểm CSs như thế nào trong thực hành lâm sàng, ví dụ như nếu CSs dương tính thì có thể bắt đầu khởi trị với TCZ hoặc hướng xử trí khác dùng corticoids liều cao, hoặc kết hợp cả hai,… Một minh chứng cho việc ứng dụng bảng điểm CSs là nghiên cứu ở Bệnh viện St. Maria14. Khi đánh giá CSs dương tính, bệnh nhân sẽ được khởi trị với TCZ và corticoid. Tuy có hạn chế lớn về cỡ mẫu nhưng kết quả cho thấy rất khả quan với 4/5 (80%) bệnh nhân không có diễn tiến giai đoạn nặng khi sử dụng TCZ kết hợp corticoid ngay khi CSs dương.
Đơn vị Dược lâm sàng tiến hành thống kê sơ bộ (descriptive analysis) về việc sử TCZ tại BV BNĐ trong điều trị COVID-19 từ tháng 07/2021-10/2021 được ghi nhận theo Bảng 8-9.
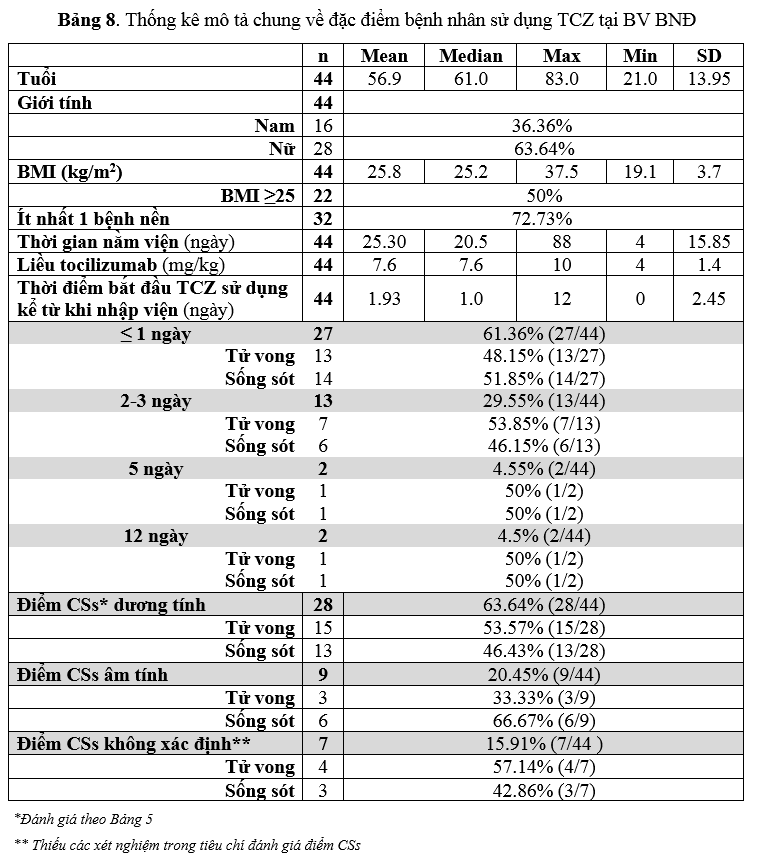
Theo Bảng 8, độ tuổi trung bình ở nhóm bệnh nhân là 57 tuổi (dao động từ 21-83 tuổi); tỷ lệ nữ giới gần gấp đôi nam giới (63.64% so với 36.36%); có 72.73% số bệnh nhân tham gia điều trị có ít nhất một bệnh nền (đái tháo đường, suy tim, COPD, ung thư, bệnh thận mạn, bệnh gan mạn, tăng huyết áp, rối loạn lipid máu, suy giáp, bệnh tim thiếu máu cục bộ). Ghi nhận 50% bệnh nhân có BMI ≥ 25 kg/m2. Điều này cho thấy đối tượng bệnh nhân được chỉ định TCZ thuộc nhóm có nhiều yếu tố nguy cơ liên quan đến tình trạng bệnh nặng và kết cục xấu hơn như các nghiên cứu khác đã chứng minh. Liều TCZ trung bình xấp xỉ bằng liều theo khuyến cáo chung (7.6 mg/kg so với 8mg/kg); giá trị liều lớn nhất vào khoảng 10mg/kg; liều thấp nhất ghi nhận là 4mg/kg (bệnh nhân tăng men gan 3-4 lần, đã hội chẩn về việc chỉnh liều qua Hội đồng điều trị COVID). Thời gian trung bình bệnh nhân nhận được liều TCZ là khoảng 1.93 ngày kể từ khi nhập viện (dao động 0-12 ngày, trung vị là 1 ngày). Trong đó, số bệnh nhân nhận được liều TCZ trong vòng 3 ngày đầu tiên kể từ khi nhập viện là 40/44 bệnh nhân (90.91%), cụ thể có 27/44 (61.36%) bệnh nhân nhận liều TCZ trong vòng 24h (≤1 ngày) và 13/44 (29.55%) nhận liều TCZ trong vòng 2-3 ngày kể từ khi nhập viện. Thời gian chỉ định TCZ tương đối phù hợp với khuyến cáo chung của Bộ y tế và NIH.
Tỷ lệ sống sót giữa các nhóm nhận điều trị với TCZ theo thời gian chỉ định kể từ khi nhập viện là không khác biệt lớn: 51.85% ở nhóm nhận điều trị trong vòng 1 ngày kể từ khi nhập viện; ở nhóm nhận điều trị từ 2-3 ngày là 46.15%. Tỷ lệ sống sót tính chung cho nhóm nhận điều trị TCZ trong vòng 3 ngày kể từ khi nhập viện là 50%. Ở các mốc thời gian dùng xa hơn kể từ khi nhập viện, tỷ lệ sống sót/tử vong là 1:1. Nguyên nhân có thể là do bệnh nhân COVID-19 được tiếp nhận và điều trị ở các tuyến bệnh viện trước đó nên khó xác định thời điểm chuyển biến nặng với những triệu chứng lâm sàng và chỉ số viêm khi được tiếp nhận vào BV BNĐ.
Về đánh giá điểm CSs, ghi nhận có 28/44 (63.64%) ca có điểm CSs dương tính và 9/44 (20.45%) CSs âm tính và 7/44 (15.91%) không xác định do thiếu các xét nghiệm cần thiết trong bảng tiêu chí đánh giá CSs. Trong 28 bệnh nhân có CSs dương tính có 15/28 (53.57%) bệnh nhân tử vong. Trong 9 bệnh nhân có CSs âm tính có 6/9 (66.67%) bệnh nhân không có diễn tiến nặng (bệnh nhân sống sót xuất viện), tuy nhiên, có 3/9 (33.33%) bệnh nhân có đánh giá CSs âm tính nhưng có diễn tiến bệnh nặng (kết cục tử vong).
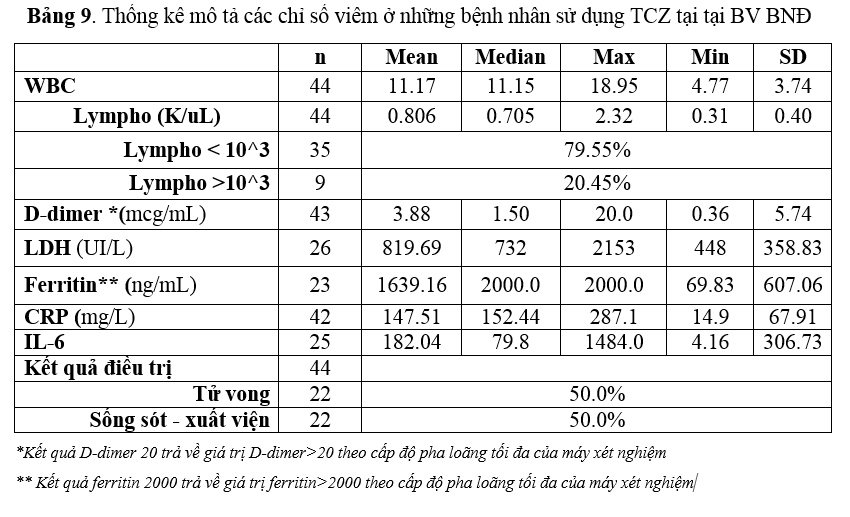
Theo Bảng 9, chỉ số lympho trung bình là 806, trong đó có 9/44 (20.45%) bệnh nhân có chỉ số lympho nền >1000. Chỉ số D-dimer trung bình là 3.88 mcg/L, cao xấp xỉ 4 lần (3880 ng/mL so với 1000 ng/mL). Thêm vào đó, LDH trung bình cao hơn khoảng 2.7 lần ( 819.69/300), ferritin cao hơn 3 lần ( 1639.16/500), CRP trung bình cao gấp hơn 1.5 lần so với thang điểm CSs (147.51 mg/L so với 100 mg/L). Kết quả điều trị chung có 22 bệnh nhân tử vong (50.0%), 22 bệnh nhân cải thiện, hồi phục và xuất viện (50.0%). Lympho <1000 là tiêu chí bắt buộc để xác định CSs dương tính nhưng ghi nhận có 3/9 bệnh nhân CSs âm tính (do không thỏa tiêu chí lympho) có diễn tiến bệnh nặng và kết cục tử vong. Do đó, tính bắt buộc của chỉ số lympho <1000 trong đánh giá CSs cần phải tiến hành nghiên cứu đủ cỡ mẫu để có khuyến cáo chính xác.
4.5. KẾT LUẬN
Khảo sát 44 bệnh nhân COVID-19 điều trị với TCZ tại BVBNĐ, ghi nhận như sau:
-
Đa số bệnh nhân được tiếp nhận điều trị là những bệnh nhân lớn tuổi (trung bình 57 tuổi); phần lớn là nữ giới (63.64%); 50% bệnh nhân thuộc nhóm thừa cân, béo phì (BMI ≥ 25) và 72.73% bệnh nhân có ít nhất một bệnh nền.
-
Thống kê sơ bộ, ghi nhận tỷ lệ sống sót/tử vong là 1:1 ở nhóm bệnh nhân sử dụng TCZ.
-
Không thấy sự khác biệt rõ rệt về tỷ lệ tử vong theo ngày dùng kể từ khi nhập viện giữa các nhóm: Sử dụng trong vòng 1 ngày; 2-3 ngày; 5 ngày và 12 ngày kể từ khi nhập viện. Nguyên nhân có thể do thời gian tiếp nhận điều trị ở bệnh viện tuyến trước trước khi được tiếp nhận và điều trị tại BVBNĐ.
-
Các xét nghiệm trong tiêu chí CSs được chỉ định thực hiện chưa thống nhất và đầy đủ dẫn đến khó khăn khi đánh giá tình trạng lâm sàng theo CSs (7/44 ca không đủ giá trị các xét nghiệm để đánh giá). Cân nhắc cáo chỉ định các xét nghiệm trong tiêu chí đánh giá CSs một cách thống nhất và đầy đủ theo các tiêu chí Bộ Y tế ban hành gồm: lympho, CRP, D-dimer, LDH, ferritin.
Trên nền tảng dữ liệu lâm sàng thu được, TCZ có thể được xem xét như một liệu pháp điều trị bổ sung bên cạnh SOC nhằm mang lại hiệu quả tối ưu nhất trong điều trị COVID-19 ở những bệnh nhân diễn tiến nặng, ngăn chặn xu hướng đến giai đoạn “cơn bão cytokine” và CSs có thể là một công cụ hữu hiệu hỗ trợ bác sĩ lâm sàng đưa ra quyết định thời điểm dùng thuốc chính xác cho bệnh nhân. Tuy nhiên, cần thêm những nghiên cứu với cỡ mẫu đủ lớn và mức độ tin cậy cao hơn để đánh giá tính khả thi và hiệu quả của công cụ CSs trong thực hành lâm sàng.
TÀI LIỆU THAM KHẢO
-
_National Institutes of Health. Treatment Guidelines Panel. Coronavirus Disease 2019 (COVID-19). Vol 2019.; 2021. https://www.covid19treatmentguidelines.nih.gov/_
-
Toniati P, Piva S, Cattalini M, et al. Tocilizumab for the treatment of severe COVID-19 pneumonia with hyperinflammatory syndrome and acute respiratory failure: A single center study of 100 patients in Brescia, Italy. Autoimmun Rev. 2020;19(7):102568. doi:10.1016/j.autrev.2020.102568
-
Mert A, Vahaboğlu H, Arslan F, et al. Tocilizumab treatment in severe COVID-19: a multicenter retrospective study with matched controls. Rheumatol Int. 2021;(0123456789). doi:10.1007/s00296-021-04965-6
-
Yang L, Xie X, Tu Z, Fu J, Xu D, Zhou Y. The signal pathways and treatment of cytokine storm in COVID-19. Signal Transduct Target Ther. 2021;6(1):1-20. doi:10.1038/s41392-021-00679-0
-
_FDA. Actemra (Tocilizumab) Injection.; 2017. https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/125276s114lbl.pdf_
-
Kaye AG, Siegel R. The efficacy of IL-6 inhibitor Tocilizumab in reducing severe COVID-19 mortality: a systematic review. PeerJ. 2020;8:1-19. doi:10.7717/peerj.10322
-
Gokhale Y, Mehta R, Kulkarni U, et al. Tocilizumab improves survival in severe COVID-19 pneumonia with persistent hypoxia: a retrospective cohort study with follow-up from Mumbai, India. BMC Infect Dis. 2021;21(1):1-10. doi:10.1186/s12879-021-05912-3
-
WHO. Therapuetics and COVID-19 LIVING GUIDELINE. Published online 2021:5-48.
-
Avni T, Leibovici L, Cohen I, et al. Tocilizumab in the treatment of COVID-19—a meta-analysis. QJM An Int J Med. 2021;(May):1-10. doi:10.1093/qjmed/hcab142
-
Ruan Q, Yang K, Wang W, Jiang L, Song J. Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. 2020;46(5):846-848. doi:10.1007/s00134-020-05991-x
-
Chen G, Wu D, Guo W, et al. Clinical and immunological features of severe and moderate coronavirus disease 2019. J Clin Invest. 2020;130(5):2620-2629. doi:10.1172/JCI137244
-
Ibañez C, Perdomo J, Calvo A, et al. High D dimers and low global fibrinolysis coexist in COVID19 patients: what is going on in there? J Thromb Thrombolysis. 2021;51(2):308-312. doi:10.1007/s11239-020-02226-0
-
Wang K, Zuo P, Liu Y, et al. Clinical and Laboratory Predictors of In-hospital Mortality in Patients with Coronavirus Disease-2019: A Cohort Study in Wuhan, China. Clin Infect Dis. 2020;71(16):2079-2088. doi:10.1093/cid/ciaa538
-
Cappanera S, Palumbo M, Kwan SH, et al. When does the cytokine storm begin in COVID-19 patients? A quick score to recognize it. J Clin Med. 2021;10(2):1-12. doi:10.3390/jcm10020297
-
Huang E, Isonaka S, Yang H, Salce E, Rosales E, Jordan SC. Tocilizumab treatment in critically ill patients with COVID-19: A retrospective observational study. Int J Infect Dis. 2021;105:245-251. doi:10.1016/j.ijid.2021.02.057
-
_Bhimraj A, Morgan RL, Shumaker AH, Lavergne V, Baden L, Cheng VC, Edwards KM, Gandhi R, Gallagher J, Muller WJ, O’Horo JC, Shoham S, Murad MH, Mustafa RA, Sultan S F-YY. Infectious Diseases Society of America Guidelines on the Treatment and Management of Patients with COVID-19. Version 5.:0-137. https://www.idsociety.org/practice-guideline/covid-19-guideline-treatment-and-management/._
-
_Bộ Y Tế. QUYẾT ĐỊNH Về việc ban hành Hướng dẫn chẩn đoán và điều trị COVID-19. BYT QĐ số 4689/QĐ-BYT. Published online 2021:137. https://kcb.vn/quyet-dinh-so-4689-qd-byt-ngay-06-10-2021-huong-dan-chan-doan-va-dieu-tri-covid-19-cap-nhat-lan-thu-7.html _