- 1. PHẢN ỨNG CÓ HẠI CỦA THUỐC (ADR):
- 2. THÔNG TIN THUỐC, CẢNH GIÁC DƯỢC:
- 3. KHUYẾN CÁO DƯỢC LÂM SÀNG QUÝ 1-2023
- 3.1. Tổng kết công tác giám sát và can thiệp dược lâm sàng:
- 3.2 Kết quả tiêu chí giám sát hồ sơ bệnh án, đơn thuốc và can thiệp DLS:
- 3.3. Khuyến cáo dược lâm sàng:
- A. MARBURG
- 1. Lược sử về bệnh do virus Marburg
- 2. Đường lây truyền
- 3. Cơ chế gây bệnh
- 4. Điều trị
- 5. Vaccine
- B. CÚM GIA CẦM A (H5N1)
- 1. Lược sử về bệnh cúm gia cầm (AH5N1)
- 2. Đường lây truyền
- 3. Điều trị
- 4. Vaccine
1. PHẢN ỨNG CÓ HẠI CỦA THUỐC (ADR):
A. Tổng kết công tác báo cáo ADR:
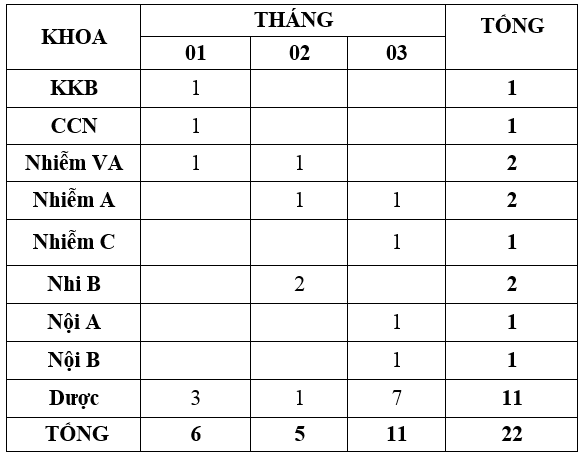
Quý 1-2023 ghi nhận có 22 báo cáo ADR xảy ra ở 9 khoa (theo bảng). Trong đó, khoa Dược báo cáo nhiều nhất 11 ca, hầu hết là các trường hợp ngoại trú nhưng không có sự tăng đột biến của cùng một chế phẩm. So với quý trước, số lượng báo cáo ADR Quý 1-2023 giảm. Các khoa lâm sàng tiếp tục tăng cường giám sát, theo dõi, xử trí và báo cáo tác dụng phụ không mong muốn của thuốc gửi về khoa Dược trên phần mềm Ehospital.
B. Phản hồi các khoa lâm sàng về chất lượng thuốc:
Không có
2. THÔNG TIN THUỐC, CẢNH GIÁC DƯỢC:
Xin xem phần THÔNG TIN THUỐC
3. KHUYẾN CÁO DƯỢC LÂM SÀNG QUÝ 1-2023
3.1. Tổng kết công tác giám sát và can thiệp dược lâm sàng:
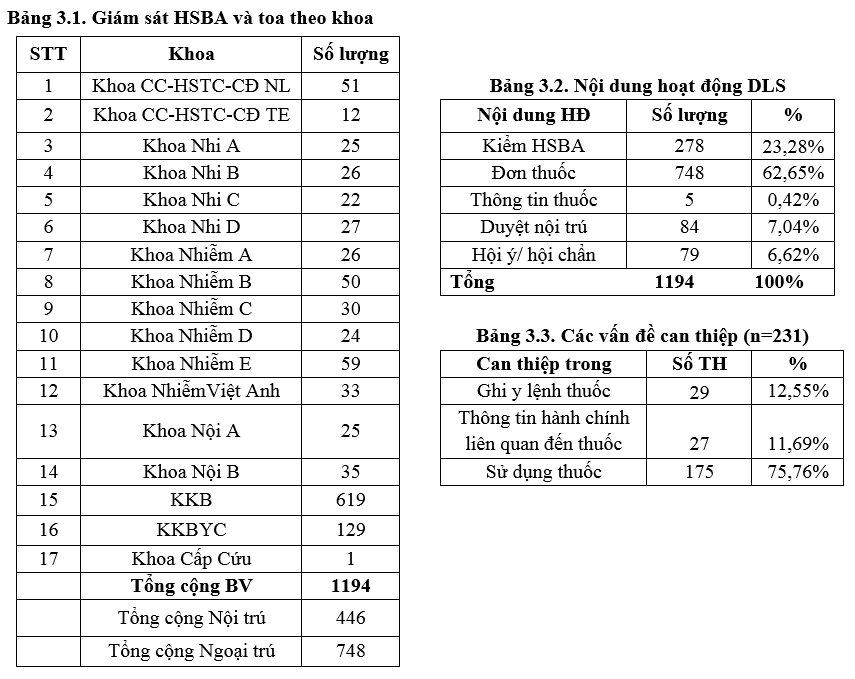
Công tác giám sát được thực hiện trên 446 TH nội trú (thấp hơn so với quý 4/2022) và 748 toa thuốc ngoại trú (giảm so với quý 4/2022) do tình hình bệnh giảm trong 3 tháng đầu năm 2023. Đơn vị dược lâm sàng thực hiện 231 can thiệp dược lâm sàng chiếm 19.4% trong các hoạt động thường quy của DLS (tăng nhẹ so với Quý 4/2022 là 17%. Chủ yếu là các can thiệp hội ý/hội chẩn về thuốc: liều kháng sinh (trong đó có 72 ca Vancomycin), phối hợp kháng sinh và tư vấn về nguy cơ tác dụng bất lợi của thuốc,…và can thiệp trực tiếp khi duyệt nội trú y lệnh hàng ngày.
Trong 231 can thiệp có 76% là can thiệp trong việc sử dụng thuốc và tương tự với Quý 4/2022 vì tình hình số bệnh nhân giảm dần. Trong Quý 1/2023, sự thống nhất ý kiến giữa dược lâm sàng và bác sĩ điều trị giảm so với quý 4/2022: 97% so với 99.6 %, có 05 trường hợp đồng ý một phần và 01 trường hợp không đồng ý chủ yếu ở các khoa khám ngoại trú và nhà thuốc bệnh viện.
3.2 Kết quả tiêu chí giám sát hồ sơ bệnh án, đơn thuốc và can thiệp DLS:
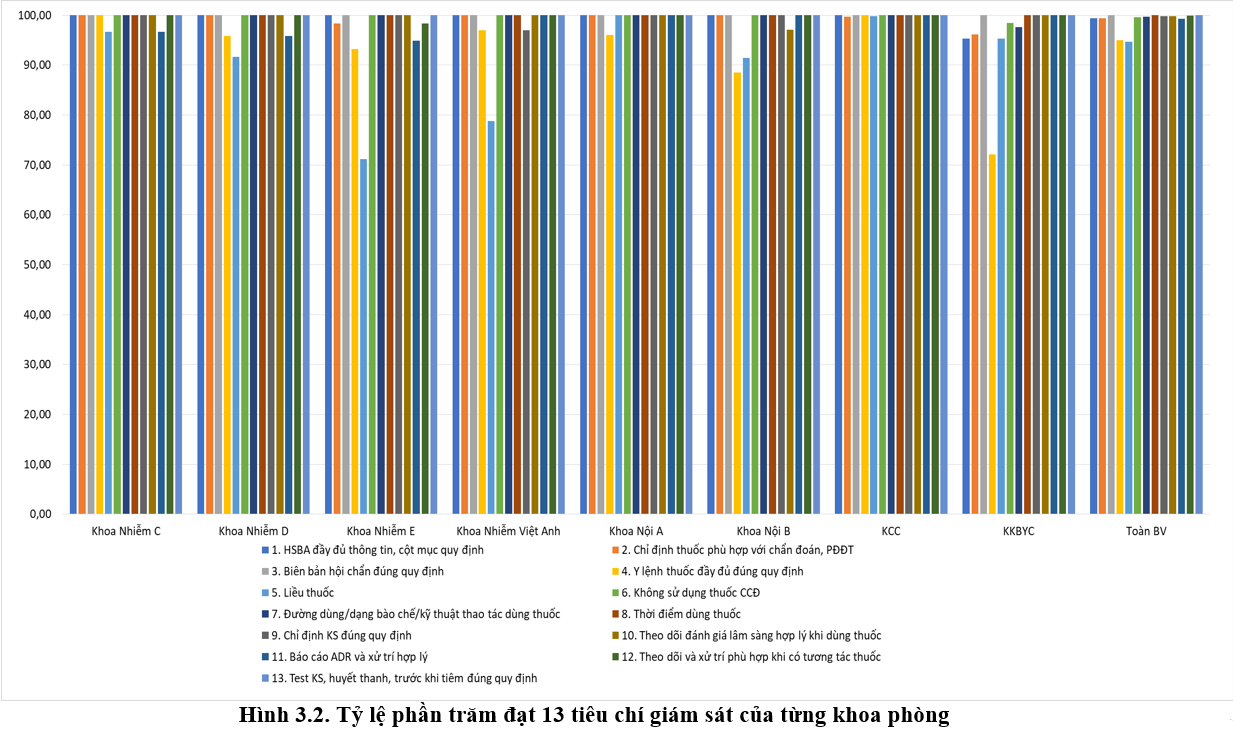
Toàn bệnh viện đạt 13 tiêu chí về sử dụng thuốc > 94% (giảm nhẹ so với Quí 4/2022 là 95%)
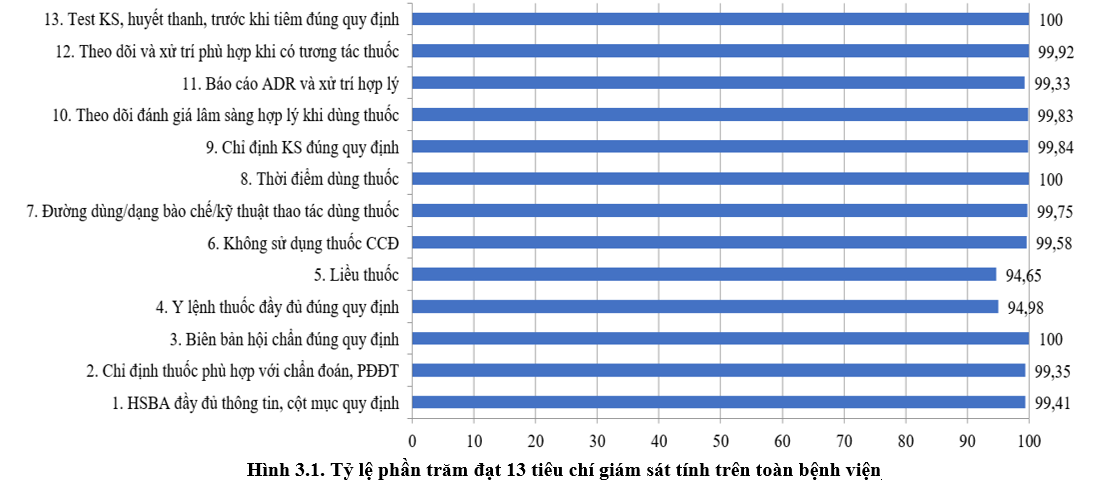
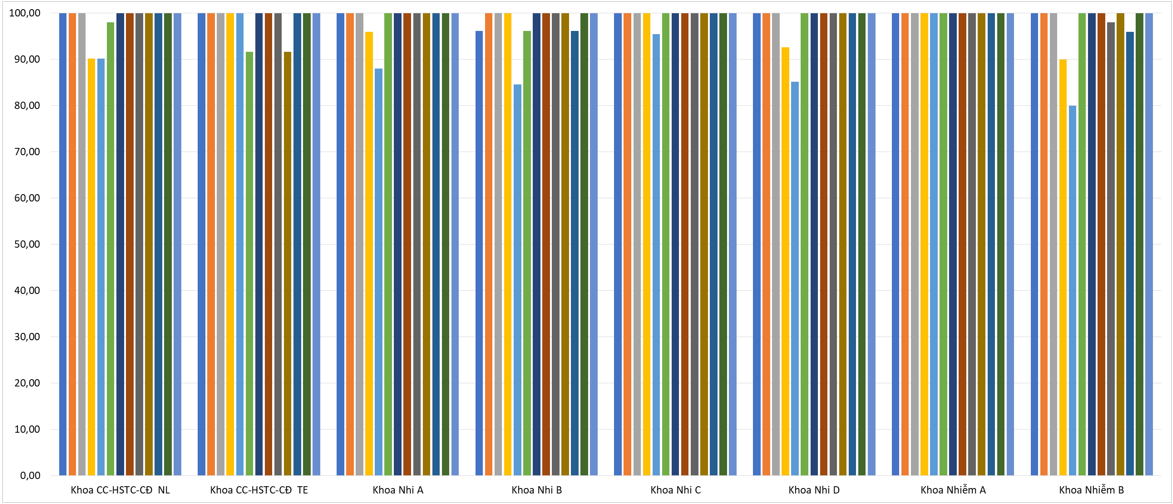
Tiêu chí liều thuốc và y lệnh đầy đủ tăng nhẹ so với Quý 4/2022. Các khoa thuộc Khối Nhi thực hiện các khuyến cáo về liều thuốc được cảnh báo từ các quý trước đã cải thiện khá nhiều nhưng vẫn cần lưu ý liều một số thuốc mới cho đối tượng trẻ em tùy theo tuổi và cân nặng; khoa Nhiễm Việt Anh, A và E cần lưu ý hội chẩn DLS về liều thuốc do người bệnh nặng và có thay đổi chức năng gan, thận. Đồng thời, các bác sĩ/điều dưỡng khi nạp y lệnh trên HIS cần chú ý để tránh trùng hoặc sai y lệnh, sai ngày giờ dùng thuốc, ở KKB và KKBYC vẫn còn một số lỗi về đánh máy toa thuốc.
3.3. Khuyến cáo dược lâm sàng:
Quy chế kê đơn:
- Khi nạp y lệnh trùng trên hệ thống HIS hoặc đánh nhầm số lượng, tên thuốc, trùng y lệnh; đặc biệt lưu ý khi choàng cử thuốc. Các sai sót này chưa xảy ra và ngăn chặn kịp thời tuy nhiên vẫn còn sai sót trong Quý 1/2023.
Ví dụ:
• Sai hàm lượng: 02 trường hợp
• Sai số lượng: 11 trường hợp
• Sai tên thuốc: 04 trường hợp
• Sai dạng bào chế: 01 trường hợp
Liều:
-
BN CKD lọc máu, nhu cầu sử dụng Amikacin PKD: khuyến cáo liều Amikacin 400 mg q12h PKD, lưu ý nguy cơ co thắt phế quản. Hiện chưa rõ về lợi ích và liều dùng của Amikacin PKD, chỉ nên xem đây là liệu pháp bổ sung (Uptodate)
-
BN Viêm não tự miễn anti-NMDAr có loạn động và sử dụng Phenobarbital PO liều tăng dần 400mg -> 600mg -> 800mg -> 900mg/ngày. Khuyến cáo theo Lưu đồ xử trí động kinh của BV: Phenobarbital IV-PO: 1-4mg/kg/ngày hoặc MAX 600mg/ngày. Cân nhắc tác dụng phụ của thuốc, đồng thời đề nghị hội chẩn xem xét về phương án điều trị và giảm liều Phenobarbital là 600mg/ngày.
-
BN (40 kg) CKD, Hb ~7, lọc máu Rx Epoeitin alpha. Liều khởi đầu của Eprex: 20-50 UI/kg x 3 lần/tuần, có thể cân nhắc 100 UI/kg x 3 lần/tuần ở Hb <8 (nên cá thể hóa theo Hb nền và nguy cơ ADR trên tim mạch). Chỉnh liều: nếu Hb không tăng >1g/dL sau 4 tuần tăng liều 25%. Nếu Hb tăng >1 g/dL trong 2 tuần hoặc tăng >2 g/dL trong 4 tuần: giảm liều 25-50% hoặc ngưng điều trị. Cần lưu ý bổ sung đủ Fe trước và trong QT điều trị với Eprex (Fe có thể bổ sung khi feritin <100 ng/mL hoặc serum transferrin saturation <20%)
-
Bệnh nhân nhiễm trùng huyết MRSA; Viêm mô tế bào cẳng tay Rx Vancomycin 1g q6h (4g/ngày), Vancomycin đáy: Ctrough = 9.3 ug/mL, AUC/MIC ước tính < 400 mcg*hr/mL, lâm sàng chưa cải thiện. Khuyến cáo chuyển Vancomycin sang chế độ truyền liên tục, cụ thể: Liều khuyến cáo: 60 mg/kg/ngày ~ 4g/ngày; chia làm 2 cử sử dụng, mỗi cử 2g, pha trong 500 mL dung môi NaCl 0.9 % hoặc Glucose 5%, truyền nhỏ giọt liên tục trong 12h. MAX Vanco 4g/ngày mà Ctrough < 10 Nên cân nhắc chế độ truyền liên tục (thường gặp ở bệnh nhân tăng thanh thải, béo phì,…)
-
Bệnh nhân Rx Vancomycin diễn tiến suy thận cấp tiến triển. Ngưng tất cả các cử Vancomycin còn lại, ước tính thời gian cần tối thiểu 3 ngày (tính từ cử sử dụng Vancomycin gần nhất) để nồng độ Vancomycin về ~ 15 ug/mL (10-20 ug/mL). Thời gian ngưng thuốc (ước tính) tùy theo từng bệnh nhân, tính theo thời gian bán thải -> Cần hội chẩn DLS. Nếu nồng độ Vancomycin đáy >> 20 ug/mL + Suy thận cấp tiến triển -> Cần có khoảng thời gian ngưng thuốc trước khi bắt đầu lại Vancomycin (hoặc đổi thuốc khác để phủ MRSA). Không dùng lại ngay Vancomycin mặc dù đã giảm liều. Theo dõi SCr mỗi ngày
-
BN cấy máu ra MRSA, số lượng ổ áp xe tăng. Khuyến cáo chuyển Vancomycin sang chế độ truyền liên tục, cụ thể: Liều khuyến cáo: 60 mg/kg/ngày ~ 4g/ngày; chia làm 2 cử sử dụng, mỗi cử 2g, pha trong 500 mL dung môi NaCl 0.9 % hoặc Glucose 5%, truyền nhỏ giọt liên tục trong 12h. Sử dụng liều load ban đầu nếu Ctrough < 10 ug/mL với chế độ truyền ngắt quãng.
-
Bệnh nhân nhiễm nấm Aspergillus xâm lấn ở phổi bội nhiễm có tổn thương gan do Voriconazole. Khuyến cáo: Giai đoạn tấn công: Liều giữ nguyên ~ 4 mg/kg, IV q12h; Giai đoạn duy trì: Giảm 1/2 liều so với khuyến cáo (liều thông thường ở bệnh nhân > 40kg là 200mg q12h). Hiện đã Rx Voriconazol N12 Dự kiến chuyển sang Voriconazol PO khi đủ 14N. Kiểm tra lại chức năng gan trước khi chuyển sang PO để quyết định hiệu chỉnh liều Voriconazol
Sử dụng thuốc:
-
Tránh nhầm lẫn với Benzathin penicillin và Benzylpenicillin, BV chỉ có Benzylpenicillin.
-
Cần hội chẩn VSLS và DLS cho các trường hợp bệnh nhân đa kháng.
-
Sử dụng caspofungin đồng thời với thuốc có thành phần Efavirenz/Rifampicin (chất cảm ứng men gan) -> Giảm nồng độ thuốc kháng nấm -> Ảnh hưởng đến hiệu quả điều trị nhiễm nấm. Khuyến cáo tăng liều caspofungin duy trì: 70 mg/ngày. Theo dõi đáp ứng lâm sàng điều trị + chức năng gan.
-
Chống chỉ định theo NSX: Vasmetin (acrivastin 8mg) CCĐ cho trẻ dưới 12 tuổi; Notired CCĐ ở trẻ em < 6 tuổi
-
Không kê 2 thuốc kháng Histamin thế hệ 2 cùng 1 đơn. Phối hợp (nếu cần) 2 thuốc kháng Histamin khác thế hệ
-
Khuyến cáo thận trọng theo NSX, độ an toàn và tác dụng của viên nén bao phim desloratadin 5mg ở trẻ < 12 tuổi chưa được đảm bảo. Khuyến cáo trẻ dưới 12 tuổi dùng dạng siro NTBV có chế phẩm ở Desloratadin 0.5mg/ml (Delopedil chai 60ml)/: 2.5ml/lần/ngày
Tương tác thuốc:
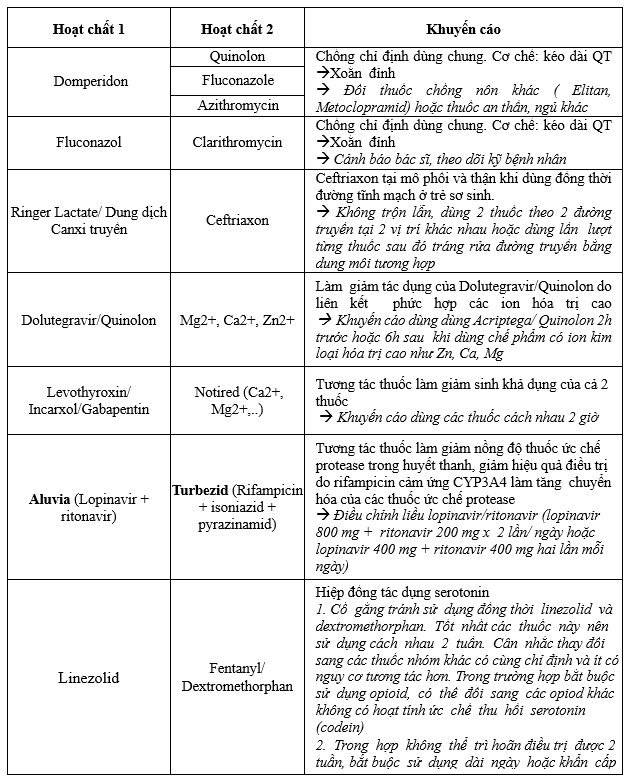
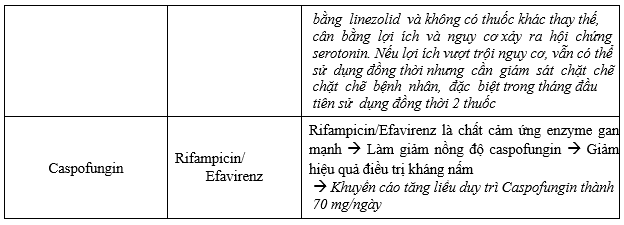
BS lưu ý khi có cảnh báo mức độ 5 và có thể chủ động liên hệ DLS hội ý về việc sử dụng chung vì các CẢNH BÁO MỨC ĐỘ 5 LÀ CHỐNG CHỈ ĐỊNH theo Quyết định Bộ Y tế ra 5948/QĐ-BYT về việc ban hành Danh mục tương tác thuốc chống chỉ định trong thực hành lâm sàng tại các cơ sở khám bệnh, chữa bệnh.
Bảng 3.4. Bảng các tương tác thuốc có khả năng xảy ra có mức độ tương tác là 5 – Severe
Khuyến cáo Hội đồng thuốc và điều trị:
- Sử dụng Triclabendazol chỉ định sán lá gan lớn Fasciolidae:
Thực hiện hội chẩn khi chỉ định cho PNCT và trẻ em < 4 tuổi và tư vấn bệnh nhân, thân nhân người bệnh về nguy cơ và lợi ích khi điều trị, cần liên hệ DSLS hội chẩn về chế độ liều cho trẻ em < 4 tuổi. Tham khảo thông tin Tờ hướng dẫn sử dụng của Nhà sản xuất.
- Điều trị ở người bệnh nhiễm PCP không sử dụng được cotrimoxazole trong thời gian không có primaquin theo phác đồ thay thế:
Phác đồ thay thế điều trị PCP dị ứng cotrimoxazole gồm primaquin+clindamycin, tuy nhiên hiện tại primaquin gián đoạn nguồn cung do đó Hội đồng khuyến cáo: Thực hiện giải mẫn cảm đối với người bệnh trước đó có dị ứng với cotrimoxazole mức độ nhẹ và trung bình (1 và 2); bệnh nhân dị ứng mức độ nặng (độ 3) cần được giải mẫn cảm một cách thận trọng. Không tiến hành giải mẫn cảm với người bệnh trước đó có tiền sử dị ứng rất nặng với cotrimoxazole hoặc các thuốc sulfamid khác.
Khuyến cáo ASP:
Ban QLSDKS giám sát các khoa trong tháng 2/2023 có Thời gian dùng KS DOT>12 ngày, Tình trạng cải thiện < 90% bao gồm các khoa: CCNL, CCN, Nhiễm VA, Nhiễm E. Kết quả: Khảo sát trên 101 bệnh nhân và 105 đợt nhiễm khuẩn.
-
Tỷ lệ không phân tầng/phân tầng không hợp lý khá cao: 22%.
-
100% có cấy vi sinh, tỷ lệ có KQ KSĐ khá cao 39%. Trong đó có 12/15 TH không nhạy với KS ban đầu nhưng hiệu quả khi xuất viện cải thiện do có điều chỉnh kháng sinh tốt.
-
Tỷ lệ sử dụng KS khởi đầu không hợp lý 10%, không sử dụng khởi đầu là 9%
-
Tỷ lệ đánh giá lâm sàng còn thấp: 63% có đánh giá lâm sàng sau 48-72h; 71% đánh giá LS khi kết thúc đợt điều trị.
-
Kết quả điều trị khi xuất viện là 74% cải thiện. Tỷ lệ chuyển viện 5%.
-
Tỷ lệ dùng KS phối hợp cao là 46%. Tỷ lệ Xuống thang kháng sinh còn thấp 7%
-
Thời gian dùng KS dài với LOT: 12,37 ngày. Nên cân nhắc để ngừng KS sớm, vài trường hợp không đánh giá LS tại ngày 7 nhưng vẫn dự kiến KS đủ 10-14 ngày.
-
Vấn đề trong phối hợp KS: Phối hợp colistin không có bằng chứng rõ ràng của nhiễm trùng vi khuẩn kháng carbapenem; Phối hợp cả Ceftriaxone và Cotrim trong mủ vết thương MRSA; Không cần phối hợp imipenem-metronidazole khi có thể dùng đơn trị Piperacillin-tazobactam hoặc ertapenem; Không có bằng chứng cho PCP nhưng khởi động Cotrim và dùng kéo dài.
-
Sử dụng KS sau KSĐ: Cấy máu Salmonella cần đổi KS sang Fluoroquinolone hay cotrim; 1 ca MSSA nhưng không xuống thang; 1 ca có thể xuống thang ceftriaxone theo KQ KSĐ.
-
Liều KS cho BN người lớn nhẹ cân: nên hội chẩn DLS. BN cân nặng 25kg, dùng Pip- tazo nên dùng 1/2 lọ 4,5 g q6h. 4. CHUYÊN ĐỀ: THÁCH THỨC TRONG LIỆU PHÁP ĐIỀU TRỊ - PHÒNG NGỪA BỆNH MARBURG VÀ CÚM GIA CẦM A (H5N1) ======
A. MARBURG
1. Lược sử về bệnh do virus Marburg
Họ Filoviridae bao gồm ba chi: Ebolavirus và Marburgvirus (Hình 1), hai mầm gây bệnh ở người; và Cuevavirus, chỉ được phát hiện ở loài dơi ở Tây Ban Nha(1)

Bệnh do virus Marburg (Marburg virus disease – MVD) là bệnh do virus có độc lực cao, gây sốt xuất huyết, với tỷ lệ tử vong lên tới 88%. Hai đợt bùng phát lớn xảy ra đồng thời ở Marburg và Frankfurt Đức; Belgrade, Serbia vào năm 1967, đây là những ca bệnh được ghi nhận đầu tiên. Sự bùng phát này có liên quan đến việc sử dụng khỉ xanh châu Phi (Cercopithecus aethiops) trong phòng thí nghiệm nhập khẩu từ Uganda. Sau đó, các đợt bùng phát và các trường hợp lẻ tẻ đã được báo cáo ở Angola, Cộng hòa Dân chủ Congo, Kenya, Nam Phi (ở một người có lịch sử du lịch đến Zimbabwe) và Uganda. Năm 2008, hai trường hợp độc lập đã được báo cáo ở những du khách đến thăm một hang động có đàn dơi Rousettus sinh sống ở Uganda(2) (Hình 2)

Vật chủ chứa virus Marburg là dơi ăn quả châu Phi (Rousettus aegyptiacus). Dơi ăn quả bị nhiễm virus Marburg không có dấu hiệu nhiễm bệnh rõ ràng. Các loài linh trưởng (bao gồm cả con người) có thể bị nhiễm virus Marburg và có thể phát triển thành bệnh nghiêm trọng với tỷ lệ tử vong cao. Cần thêm nhiều nghiên cứu để xác định xem các loài khác cũng có thể mang virus Marburg hay không(3).
Trong đợt bùng phát gần đây, một trường hợp tử vong ở người do bệnh do virus Marburg đã được phát hiện ở Guinea vào tháng 8 năm 2021 và hai trường hợp tử vong đã được phát hiện ở Ghana vào tháng 7 năm 20221.
Theo số liệu cập nhật mới nhất trong năm 2023, ghi nhận 9 trường hợp nhiễm bệnh ở Guinea Xích đạo (trong đó có 7 trường hợp tử vong – cập nhật đến ngày 13/02/2023) và 8 ca nhiễm ở Tanzania (trong đó có 5 trường hợp tử vong – cập nhật đến ngày 21/03/2023)(3–5).
2. Đường lây truyền
Virus Marburg lây lan từ người sang người theo cùng cơ chế như virus Ebola: Thông qua tiếp xúc trực tiếp với máu hoặc các chất dịch cơ thể khác (nước bọt, mồ hôi, chất nôn, phân, nước tiểu, tinh dịch, dịch ối ở phụ nữ mang thai, sữa mẹ) của bệnh nhân hoặc trong quá trình xử lý thi thể, chôn cất người bệnh. Ví dụ, việc điều trị cho 25 bệnh nhân trong đợt bùng phát ở Đức và Nam Tư đã dẫn đến 6 ca nhiễm chéo giữa các bác sĩ và y tá(1–6).
Không có dữ liệu nào cho thấy virus Marburg lây truyền qua người bởi vết chích/đốt do muỗi hoặc các loài chân khớp khác. Ngoài ra, mặc dù động vật thí nghiệm đã bị nhiễm bệnh do tiếp xúc với virus qua khí dung, nhưng không có bằng chứng nào cho thấy bệnh nhân mắc bệnh do virus Marburg đã truyền bệnh cho người khác qua đường hô hấp(1).
3. Cơ chế gây bệnh
Sau khi virus xâm nhập vào cơ thể thông qua da hoặc màng nhầy, đại thực bào và tế bào đuôi gai (dendritic cells) là những tế bào đầu tiên bị nhiễm bệnh. Các filovirus (thuật ngữ chỉ virus Ebola và Marburg) nhân lên dễ dàng bên trong các tế bào "lính gác" này (gồm đại thực bào và tế bào đuôi gai), gây hoại tử và phóng thích một số lượng lớn các hạt virus mới tạo sự lây lan đến các tế bào đuôi gai và đại thực bào cố định và di động trong gan, lách và các mô bạch huyết khác. Hai protein được mã hóa bởi virus, VP24 và VP35, ngăn chặn sản xuất interferon typ I và ức chế đáp ứng với interferon ngoại sinh. Tóm lại, cơ chế gây bệnh chính của virus Marburg là: Gây phản ứng viêm toàn thân và Gây suy giảm khả năng miễn dịch thu nhận(1) (Hình 3).

Thời gian ủ bệnh của MVD là từ 2 đến 9 ngày. Triệu chứng khởi phát đột ngột và được đánh dấu bằng sốt, ớn lạnh, nhức đầu và đau cơ(1–3,6) (Hình 4).
4. Điều trị
Kiểm soát bệnh MVD dựa vào chăm sóc hỗ trợ tích cực để ngăn chặn sự tiến triển đến tình trạng sốc do phản ứng viêm hệ thống của cơ thể. Cách tiếp cận, chăm sóc, hỗ trợ cũng như các biện pháp phòng ngừa và kiểm soát bệnh nhiễm được sử dụng khi chăm sóc bệnh nhân nhiễm virus Marburg tương tự như cách chăm sóc bệnh nhân mắc bệnh do virus Ebola(1,2,4,6).
Không có phương pháp điều trị cụ thể nào được phê duyệt cho bệnh MVD. Các liệu pháp kháng virus đã được phê duyệt để điều trị bệnh do virus Ebola, bao gồm các kháng thể đơn dòng chống lại glycoprotein bề mặt của virus Zaire ebolavirus cho thấy không có hiệu quả đối với virus Marburg(1,3,6).
Dựa trên cơ chế bệnh sinh của bệnh, các “ứng viên thuốc” được thử nghiệm bao gồm:
Kháng thể đơn dòng (Monoclonal antibodies – mabs):
Vào năm 2015, một nhóm các nhà nghiên cứu đã phân lập các tế bào B từ một người sống sót sau nhiễm virus Marburg và tạo ra một nhóm các kháng thể đơn dòng (mabs), các mabs đã được thử nghiệm trên động vật trong phòng thí nghiệm(7):
Một liều duy nhất của mab MR191-N được chỉ định, sau 4 ngày thử nghiệm có thể ngăn chặn cái chết của chuột lang bị nhiễm virus Ravn (biến chủng của virus Marburg) hoặc virus Angola (virus Marburg gây bệnh nhiễm ở khỉ Rhesus ở Angola)(8).
Một con khỉ Rhesus được bảo vệ bằng mab tương tự khi được tiêm hai liều vào ngày thứ 5 và thứ 8 sau phơi nhiễm với một trong hai loại virus trên.
Sự phát triển tiếp theo của những mab này đã tạo ra MR186-YTE, một phiên bản của MR-191 được biến đổi để có thời gian bán thải trong huyết thanh kéo dài hơn(9).
Các chất tương tự nucleoside/nucleotide (Nucleoside/nucleotide analogs-NAs)
– Một số chất tương tự nucleostide đã chứng tỏ hoạt tính kháng virus Marburg như:
Favipiravir (T-705): Là một dẫn xuất pyrazinecarboxamide đã cho thấy hoạt tính kháng virus rộng rãi và được cấp phép sử dụng tại Nhật Bản để điều trị bệnh cúm. Trong một thử nghiệm cho thấy có tác dụng bảo vệ ở chuột và các loài linh trưởng, thí nghiệm được tiến hành với việc gây nhiễm bằng một liều virus Marburg ở ngưỡng gây chết. Favipiravir đã được xem xét, đánh giá ở những bệnh nhân mắc bệnh do virus Ebola ở Tây Phi nhưng do không đạt được các mục tiêu về hiệu quả nên việc sử dụng thuốc này đã bị ngừng(1,3,10).
Remdesivir: Trong thí nghiệm trên khỉ đuôi dài cho thấy kết quả đã ngăn chặn cái chết của 5/6 con khỉ được tiêm một lần mỗi ngày trong 12 ngày, thí nghiệm với một liều virus ngưỡng gây chết với chủng virus Marburg ở Angola. Điều trị khỉ Rhesus bị nhiễm chủng virus Marburg ở Angola bằng sự kết hợp giữa remdesivir và MR186-YTE cho kết quả tốt hơn so với điều trị riêng lẻ; tất cả các động vật đều sống sót khi bắt đầu điều trị 6 ngày sau khi thử nghiệm với virus. Remdesivir đã được xem xét, đánh giá để điều trị bệnh do virus Ebola trong thử nghiệm PALM ở DRC nhưng được phát hiện là kém hiệu quả hơn so với các liệu pháp điều trị bằng mab(1,9,11).
Chất BCX4430 (galidesivir): Một loại thuốc phổ rộng tiềm năng chống lại virus RNA, đã được đánh giá trong các nghiên cứu trên động vật để điều trị virus Marburg và cho thấy có hiệu quả ban đầu.(1,12)
5. Vaccine
Cho đến hiện tại, không có vaccine nào được phê duyệt để phòng ngừa bệnh do virus Marburg và những vaccine được sử dụng để ngăn ngừa bệnh do virus Ebola không chắc mang lại lợi ích gì đối với bệnh MVD. Cho đến khi có vaccine, quản lý và kiểm soát chặt chẽ sức khỏe cộng đồng là chìa khóa để kiểm soát sự bùng phát của bệnh do virus Marburg(1). Các loại “ứng viên vaccine” bao gồm:
Vaccine VSV – Năm 2005, một liều vaccine tái tổ hợp mã hóa glycoprotein bề mặt virus gây viêm miệng mụn nước (VSV) cho thấy khả năng bảo vệ hoàn toàn khỉ Cynomolgus trong thử nghiệm với liều virus ngưỡng gây chết bởi chủng Musoke của virus Marburg ở hồ Victoria. Một nhóm hợp tác đã phát triển một loại vaccine VSV tái tổ hợp tứ giá mã hóa glycoprotein bề mặt của virus Marburg ở Angola, virus Ebola chủng Zaire và Sudan và virus Lassa. Kết quả cho thấy vaccine kết hợp bảo vệ khỉ Cynomolgus chống lại từng chủng virus trong cả bốn chủng virus(1,13,14).
Vaccine Adenovirus/Vaccine biến đổi Ankara (MVA) – Một loại vaccine kháng virus đa giá mã hóa glycoprotein từ virus Zaire Ebola, virus Sudan, virus Taï Forest và virus Marburg đã được phát triển. Các glycoprotein này được biểu hiện bởi adenovirus serotype 26 và 35 và các vec-tơ MVA. Khỉ Cynomolgus được chủng ngừa vaccine kết hợp đa giá này đã được bảo vệ trong thử nghiệm với cả bốn loại virus trên(15). Ngoài ra, các nghiên cứu giai đoạn I về sự kết hợp Ad26/MVA chống lại virus Ebola và Marburg ở cả người lớn và trẻ em đã được tiến hành ở Sierra Leone và không có mối lo ngại nào về an toàn được ghi nhận(1,16).
Vaccine adenovirus tái tổ hợp từ tinh tinh – Một thử nghiệm lâm sàng đã đánh giá vaccine adenovirus typ 3 (cAd3) tái tổ hợp từ tinh tinh mã hóa glycoprotein của virus Marburg loại hoang dã (cAd3-Marburg) ở Angola trên 40 người trưởng thành khỏe mạnh. Sau một lần tiêm vaccine liều duy nhất, phản ứng kháng thể đặc hiệu với glycoprotein đã được phát hiện ở 95% và 70% số người tham gia ở tuần thứ 4 và 48. Không có tác dụng phụ nghiêm trọng nào liên quan đến tiêm chủng xảy ra(1,17).
Tóm lại, MVD là bệnh do virus có độc lực cao, gây sốt xuất huyết, với tỷ lệ tử vong cao và cho đến thời điểm hiện tại chưa có thuốc điều trị hoặc vaccine phòng bệnh nào được các cơ quan quản lý cấp duyệt chính thức. Các loại thuốc, vaccine dùng trong bệnh dịch do virus Ebola không cho thấy hiệu quả điều trị trên virus Marburg. Những kinh nghiệm trong việc tiếp cận, chăm sóc, hỗ trợ cũng như các biện pháp phòng ngừa và kiểm soát bệnh nhiễm Ebola có thể áp dụng với bệnh nhân nhiễm Marburg(1).
B. CÚM GIA CẦM A (H5N1)
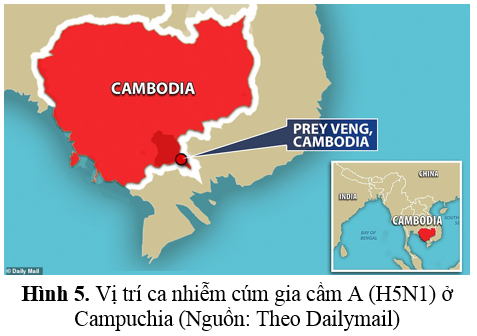
Vào ngày 23 tháng 2 năm 2023, Cơ quan đầu mối quốc gia (NFP) của Cơ quan Quản lý Y tế Quốc tế (IHR) ở Campuchia đã báo cáo WHO một trường hợp được xác nhận nhiễm virus cúm gia cầm A (H5N1) ở người. Một ngày sau, ca thứ hai đã được báo cáo là một người có liên hệ trong gia đình của trường hợp đầu tiên. Một cuộc điều tra ổ dịch đang được tiến hành bao gồm việc xác định mức độ phơi nhiễm của hai trường hợp được báo cáo này với virus.
Đây là hai trường hợp cúm gia cầm A (H5N1) đầu tiên được báo cáo tại Campuchia kể từ năm 2014. Đáng lưu ý, nơi ghi nhận 2 ca nhiễm cúm gia cầm A (H5N1) thuộc tỉnh Prey Veng, ngay sát biên giới với các tỉnh phía nam Việt Nam (Hình 5).
Nhiễm H5N1 ở người có thể gây bệnh nặng, có tỷ lệ tử vong cao18. Câu hỏi đặt ra là: Cho đến thời điểm hiện tại đã có những loại thuốc đặc trị và vaccine dự phòng nào cho cúm gia cầm A (H5N1)?
1. Lược sử về bệnh cúm gia cầm (AH5N1)
Cúm gia cầm (Bird flu hay Avian flu) là một loại cúm truyền nhiễm lây lan giữa các loài chim. Mười sáu phân nhóm virus hemagglutinin (H1-H16) và chín phân nhóm neuraminidase (N1-N9) xuất hiện trong ổ chứa tự nhiên là loài chim sống dưới nước. Chỉ có ba phân nhóm hemagglutinin (H1, H2 và H3) gây nhiễm trùng đường hô hấp trên diện rộng ở người. Virus cúm B rất hiếm khi được mang theo bởi các loài chim và hầu hết chúng không lây nhiễm cho con người. Những năm gần đây có 4 chủng gây lo ngại: H5N1 (1997), H7N9 (2013), H5N6 (2014), H5N8 (2016). Mặc dù H5N1, H7N9 và H5N6 không lây nhiễm sang người một cách dễ dàng và thường không lây lan từ người sang người, nhưng một số người đã bị nhiễm bệnh trên khắp thế giới, dẫn đến một số ca tử vong(19,20).
Virus cúm gia cầm độc lực cao A(H5N1) là loài đặc hữu trong các quần thể chim và gia cầm hoang dã ở các nước châu Á. Từ năm 2003 đến nay, hơn 880 trường hợp ở người tại 19 quốc gia đã được báo cáo cho Tổ chức Y tế Thế giới 20. Riêng 4 quốc gia ở khu vực Tây Thái Bình Dương trong đó có Việt Nam, tính đến ngày 16 tháng 3 năm 2023, có tổng số 240 trường hợp nhiễm virus cúm gia cầm A (H5N1) ở người được báo cáo kể từ tháng 1 năm 2003 (Bảng 1). Trong số này trường hợp, 135 trường hợp tử vong, dẫn đến tỷ lệ tử vong là 56%. Trường hợp cuối cùng được báo cáo trước năm 2023 đến từ Trung Quốc, khởi phát ngày 22 tháng 9 năm 2022 và qua đời vào ngày 18 tháng 10 năm 2022. (21)

2. Đường lây truyền
Gia cầm sang người – Việc lây truyền cúm gia cầm từ gia cầm sang người có thể xảy ra nếu virus phát tán trong dịch tiết hoặc chất thải của gia cầm xâm nhập vào mắt, mũi hoặc miệng của một người hoặc bị hít phải. Những người có nguy cơ cao bị nhiễm cúm gia cầm là: người tiếp xúc gần hoặc kéo dài với gia cầm bị nhiễm bệnh hoặc chất tiết, chất thải của vật nuôi bị nhiễm mà không có thiết bị bảo hộ (bao gồm áo choàng, găng tay, khẩu trang và kính bảo vệ mắt). Tiếp xúc với gia cầm bệnh hoặc chết trong tuần trước khi mắc bệnh là yếu tố rủi ro phổ biến nhất gây nhiễm cúm gia cầm cho người(20,22,23) (Hình 7)

Từ người sang người − Đã xảy ra sự lây truyền hạn chế, không bền vững từ người sang người của cúm gia cầm H5N1 và H7N9; cho đến nay, không có bằng chứng về sự lây truyền bền vững từ người sang người(20)

Thời gian ủ bệnh đối với người nhiễm virus cúm gia cầm H5N1 và H7N9 thường là từ 3 đến 5 ngày nhưng cũng có thể kéo dài từ 7 đến 10 ngày. Các dấu hiệu và triệu chứng có thể bao gồm sốt và ho (2 triệu chứng phổ biến nhất), khó thở, đau ngực và đau cơ; khó chịu, nhức đầu, tiêu chảy và đau họng có thể xảy ra nhưng ít phổ biến hơn. Các biến chứng có thể bao gồm viêm phổi, suy hô hấp, tổn thương thận cấp tính, tiêu cơ vân, đông máu nội mạch lan tỏa, viêm não màng não và đồng nhiễm vi khuẩn hoặc nấm gây bệnh. (22,23,25)
3. Điều trị
Điều trị bằng thuốc kháng virus nên được thực hiện cho tất cả các trường hợp đã xác nhận, có thể xảy ra và nghi ngờ nhiễm cúm gia cầm. Khuyến cáo điều trị bằng thuốc kháng virus càng sớm càng tốt; nên bắt đầu điều trị ngay cả khi đã hơn 48 giờ kể từ khi khởi phát bệnh. Điều trị đặc biệt quan trọng đối với những người có nguy cơ cao bị biến chứng cúm. Những đối tượng thuộc nhóm nguy cơ cao bao gồm(26):
-
Trẻ em <5 tuổi, nhưng đặc biệt là <2 tuổi
-
Người lớn ≥ 65 tuổi
-
Phụ nữ đang mang thai hoặc đến 2 tuần sau khi sinh
-
Cư dân của viện dưỡng lão và các cơ sở chăm sóc dài hạn
-
Những người có sẵn bệnh lý nền: hen suyễn, bệnh phổi mãn tính, các rối loạn về máu, bệnh gan, bệnh thận, bệnh lý chuyển hóa, béo phì,…
Trong một nghiên cứu phân tích 2010, hơn 300 bệnh nhân mắc cúm gia cầm A (H5N1) được điều trị bằng oseltamivir có tỷ lệ tử vong thấp hơn so với những người không được điều trị bằng thuốc kháng virus (hazard ratio 0.51, 95% CI 0.34-0.77). Lợi ích về tỷ lệ tử vong là lớn nhất khi bắt đầu điều trị trong vòng 2 ngày đầu tiên sau khi khởi phát triệu chứng nhưng một số lợi ích vẫn tồn tại cho đến 6 đến 8 ngày sau khi khởi phát triệu chứng(27).
Trong một nghiên năm 2012 về thời điểm sử dụng thuốc – hiệu quả thuốc kháng virus, 215 bệnh nhân bị nhiễm cúm gia cầm A(H5N1), tỷ lệ tử vong ở những người được điều trị oseltamivir trong vòng 2 ngày kể từ khi khởi phát triệu chứng thấp hơn so với những người được điều trị muộn hơn (18% so với 63%)28. Trong một nghiên cứu khác bao gồm 193 trẻ em bị nhiễm cúm gia cầm A(H5N1), nguy cơ tử vong tăng lên mỗi ngày nếu chậm trễ trong việc bắt đầu dùng oseltamivir (odds ratio 1.75, 95% CI 1.17-2.61)(29).
Đối với những bệnh nhân ngoại trú mắc bệnh không biến chứng, không sốt và các triệu chứng gần như đã khỏi, quyết định bắt đầu điều trị bằng thuốc kháng virus nên được đưa ra tùy theo từng trường hợp. Những người không được điều trị bằng thuốc kháng virus nên được theo dõi chặt chẽ về sự tiến triển của bệnh(26,30). Các nhóm thuốc kháng virus điều trị bệnh cúm bao gồm:
Chất ức chế neuraminidase: oseltamivir, zanamivir và peramivir
Chất ức chế chọn lọc endonuclease: baloxavir
Chất ức chế kênh adamantanes (còn được gọi là ion M2): amantadine và rimantadine
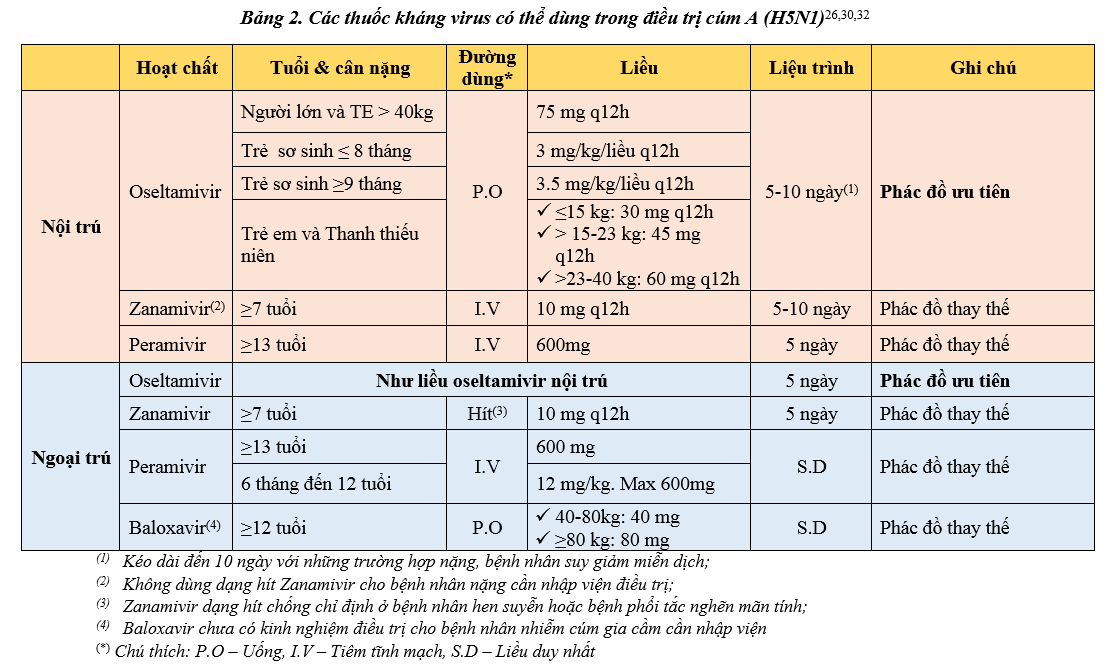
Trong đó, các chất ức chế neuraminidase là phương pháp điều trị chính. Baloxavir có hoạt tính chống lại virus cúm A và B, đã được phê duyệt ở Nhật Bản và Hoa Kỳ để điều trị bệnh cúm theo mùa không biến chứng; tuy nhiên, cho đến nay, không có kinh nghiệm lâm sàng về việc sử dụng thuốc này để điều trị cúm gia cầm ở người. Adamantanes không nên được sử dụng để điều trị bệnh cúm do tỷ lệ kháng thuốc cao giữa các loại virus cúm A. Cách tiếp cận lựa chọn thuốc kháng virus để điều trị cúm gia cầm phần lớn dựa trên dữ liệu về hiệu quả điều trị cúm theo mùa(26,30).
Oseltamivir đường uống là phác đồ ưu tiên để điều trị cúm gia cầm ở bệnh nhân nhập viện cũng như ngoại trú. Thời gian có thể kéo dài đến 10 ngày đối với những bệnh nhân nặng hoặc suy giảm miễn dịch do đã quan sát thấy nồng độ virus cúm gia cầm tăng cao so với cúm mùa. Việc tăng liều oseltamivir không có vai trò gì do thiếu bằng chứng lợi ích. Ngoài ra, cho đến nay, dữ liệu lâm sàng không hỗ trợ việc sử dụng liệu pháp kháng virus kết hợp để điều trị cúm gia cầm hoặc cúm theo mùa.
Có bốn loại thuốc kháng virus cúm được FDA phê chuẩn, CDC khuyến nghị sử dụng trong các đợt virus cúm lưu hành 31. Tóm tắt các thuốc kháng virus có thể dùng trong điều trị cúm A (H5N1) theo Bảng 2.
4. Vaccine
Các loại vaccine cúm gia cầm đã được phê duyệt đến hiện tại gồm:
-
Vaccine cúm gia cầm H5N1 tái tổ hợp dưới đơn vị virus không tá dược (non-adjuvanted subvirion H5N1 vaccine) đã được FDA phê duyệt vào năm 2007.
-
Vaccine cúm gia cầm H5N1 tái tổ hợp dưới đơn vị virus dạng nhũ tương dầu/nước có tá dược (AS03) (oil-in-water emulsion (AS03)-adjuvanted subvirion H5N1 vaccine) đã được phê duyệt để sử dụng trước đại dịch ở Liên minh Châu Âu vào năm 2008 và tại Hoa Kỳ vào năm 2013.
-
Vaccine H5N1 tái tổ hợp đơn giá có tá dược MF59 (MF59-adjuvanted monovalent H5N1 vaccine) đã được phê duyệt tại Hoa Kỳ vào năm 2020
Các loại vaccine H5N1 khác như: Vaccine H5N1 toàn virus (Whole-virion H5N1 vaccines), vaccine dạng liposome (Virosomal vaccine), vaccine véc-tơ virus biến đổi (Modified vaccinia virus vector vaccine) đang được nghiên cứu và thử nghiệm lâm sàng các giai đoạn khác nhau.
Việc sản xuất vaccine H5N1 bằng các phương pháp thông thường bị cản trở bởi những khó khăn về kỹ thuật sản xuất và khả năng sinh miễn dịch khiêm tốn ở những người chưa có miễn dịch, có khả năng cần phải tiêm nhiều liều vaccine để tạo ra huyết thanh bảo vệ. Ngoài ra, quá trình tiến hóa di truyền giữa các virus cúm gia cầm H5N1 đang lưu hành đã tạo ra một số nhóm và phân nhóm virus đa dạng về mặt kháng nguyên, gây khó khăn trong việc lựa chọn các virus phù hợp nhất để chuẩn bị vaccine trước đại dịch33. Các công cụ phòng ngừa cúm gia cầm bao gồm kiểm soát lây nhiễm, dự phòng sau phơi nhiễm và phát triển vaccine(26).
DS. Đặng Hửu Lể - Đơn vị TTT-DLS BVBNĐ
TÀI LIỆU THAM KHẢO
1. Mike Bray, MD, MPH, Daniel S Chertow, MD M. Marburg virus. UpToDate. 2023.
2. World Health Organization. Marburg virus disease.2022.
3. U.S. Centers for Disease Control and Prevention. Marburg (Marburg Virus Disease) | Marburg (Marburg Virus Disease).https://www.cdc.gov/vhf/marburg/index.html. Published 2023. Accessed March 28, 2023.
4. The Africa Centres for Disease Control and Prevention. Republic of Tanzania declares Marburg Virus Disease (MVD) Outbreak.https://africacdc.org/news-item/republic-of-tanzania-declares-marburg-virus-disease-mvd-outbreak/. Published 2023. Accessed March 28, 2022.
5. World Health Organization. Marburg virus disease - Equatorial Guinea.https://www.who.int/emergencies/disease-outbreak-news/item/marburg-virus-disease---guinea. Published 2022. Accessed March 28, 2023.
6. European Centre for Disease Prevention and Control Prevention D. European Centre for Disease Prevention and Control Disease factsheet about tetanus Clinical features and sequelae.https://www.ecdc.europa.eu/en/infectious-disease-topics/z-disease-list/ebola-virus-disease/facts/factsheet-about-marburg-virus. Published 2022. Accessed March 28, 2023.
7. Flyak, A. I., Ilinykh, P. A., Murin, C. D., Garron, T., Shen, X., Fusco, M. L., Hashiguchi, T., Bornholdt, Z. A., Slaughter, J. C., Sapparapu, G., Klages, C., Ksiazek, T. G., Ward, A. B., Saphire, E. O., Bukreyev, A., & Crowe, J. E. J. Mechanism of human antibody-mediated neutralization of Marburg virus. Cell. 2015;160(5):893–903. doi:https://doi.org/10.1016/j.cell.2015.01.031
8. Jinhee Hur, Stephanie A. Smith-Warner, Eric B. Rimm, Walter C. Willett, Kana Wu, Yin Cao EG. Therapeutic treatment of Marburg and Ravn virus infection in nonhuman primates with a human monoclonal antibody. J Int Soc Burn Inj. 2017;43(5):909-932. doi:10.1126/scitranslmed.aai8711.Therapeutic
9. Cross RW, Bornholdt ZA, Prasad AN, et al. Combination therapy protects macaques against advanced Marburg virus disease. Nat Commun. 2021;12(1):1-10. doi:10.1038/s41467-021-22132-0
10. Bixler SL, Bocan TM, Wells J, et al. Efficacy of favipiravir (T-705) in nonhuman primates infected with Ebola virus or Marburg virus. Antiviral Res. 2018;151(December 2017):97-104. doi:10.1016/j.antiviral.2017.12.021
11. Porter DP, Weidner JM, Gomba L, et al. Remdesivir (GS-5734) Is Efficacious in Cynomolgus Macaques Infected with Marburg Virus. J Infect Dis. 2020;222(11):1894-1901. doi:10.1093/infdis/jiaa290
12. Julander JG, Demarest JF, Taylor R, et al. An update on the progress of galidesivir (BCX4430), a broad-spectrum antiviral. Antiviral Res. 2020;(January).
13. Jones SM, Feldmann H, Ströher U, et al. Live attenuated recombinant vaccine protects nonhuman primates against Ebola and Marburg viruses. Nat Med. 2005;11(7):786-790. doi:10.1038/nm1258
14. Cross RW, Eldridge JH, Geisbert TW, et al. Quadrivalent VesiculoVax vaccine protects nonhuman primates from viral-induced hemorrhagic fever and death. J Clin Invest. 2020;130(1):539-551.
15. Callendret B, Vellinga J, Wunderlich K, et al. A prophylactic multivalent vaccine against different filovirus species is immunogenic and provides protection from lethal infections with Ebolavirus and Marburgvirus species in non-human primates. PLoS One. 2018;13(2):1-24. doi:10.1371/journal.pone.0192312
16. Milligan ID, Gibani MM, Sewell R, et al. Safety and immunogenicity of novel adenovirus type 26-and modified vaccinia Ankara-vectored Ebola vaccines: A randomized clinical trial. JAMA - J Am Med Assoc. 2016;315(15):1610-1623. doi:10.1001/jama.2016.4218
17. Hamer MJ, Houser K V, Hofstetter AR, et al. Safety, tolerability, and immunogenicity of the chimpanzee adenovirus type 3-vectored Marburg virus (cAd3-Marburg) vaccine in healthy adults in the USA: a first-in-human, phase 1, open-label, dose-escalation trial. Lancet (London, England). 2023;401(10373):294-302. doi:10.1016/S0140-673602400-X
_18. World Health Organization. Disease Outbreak News; Avian Influenza A (H5N1) - Cambodia.; 2023. https://www.who.int/emergencies/disease-outbreak-news/item/2023-DON445_
_19. National Health Service (NHS). Bird flu in the UK. Published 2022. Accessed March 30, 2023. https://www.nhs.uk/conditions/bird-flu/_
20. Iain Stephenson, MD F. Avian influenza: Epidemiology and transmission. UpToDate. 2023.
21. World Health Organization, Region WP. Avian Influenza Weekly Update Number 887.; 2023.
22. Centers for Disease Control and Prevention NC for I and RD (NCIRD). Information on Bird Flu | Avian Influenza (Flu).https://www.cdc.gov/flu/avianflu/index.htm. Published 2023.
_23. World Health Organization. Influenza Avian and other Zoonotic influenza. Published 2018. https://www.who.int/health-topics/influenza-avian-and-other-zoonotic#tab=tab_1_
24. Korteweg C, Gu J. Pathology, molecular biology, and pathogenesis of avian influenza A (H5N1) infection in humans. Am J Pathol. 2008;172(5):1155-1170. doi:10.2353/ajpath.2008.070791
25. Iain Stephenson, MD F. Avian influenza: Clinical manifestations and diagnosis. UpToDate. 2023.
26. Iain Stephenson, MD F. Avian influenza: Treatment and prevention. UpToDate. 2023.
27. Adisasmito W, Chan PKS, Lee N, et al. Effectiveness of antiviral treatment in human influenza A(H5N1) infections: analysis of a Global Patient Registry. J Infect Dis. 2010;202(8):1154-1160. doi:10.1086/656316
28. Chan PKS, Lee N, Zaman M, et al. Determinants of antiviral effectiveness in influenza virus A subtype H5N1. J Infect Dis. 2012;206(9):1359-1366. doi:10.1093/infdis/jis509
29. Oner AF, Dogan N, Gasimov V, et al. H5N1 avian influenza in children. Clin Infect Dis an Off Publ Infect Dis Soc Am. 2012;55(1):26-32. doi:10.1093/cid/cis295
_30. Centres for Disease Control and Prevention. Interim Guidance on the Use of Antiviral Medications for Treatment of Human Infections with Novel Influenza A Viruses Associated with Severe Human Disease | Avian Influenza (Flu). Centres Dis Control Prev. Published online 2015:16-21. http://www.cdc.gov/flu/avianflu/novel-av-treatment-guidance.htm#socialMediaShareContainer_
_31. US Food and Drug Administration. Influenza (Flu) Antiviral Drugs and Related Information. Published online 2022:8-10. https://www.fda.gov/drugs/information-drug-class/influenza-flu-antiviral-drugs-and-related-information#ApprovedDrugs_
_32. U.S. Centers for Disease Control and Prevention. Antiviral Dosage. Published online 2016. https://www.cdc.gov/flu/professionals/antivirals/antiviral-dosage.htm_
33. Iain Stephenson, MD F. Avian influenza vaccines. UpToDate. 2023.