- 1. PHẢN ỨNG CÓ HẠI CỦA THUỐC (ADR):
- 2. THÔNG TIN THUỐC, CẢNH GIÁC DƯỢC:
- 3. KHUYẾN CÁO DƯỢC LÂM SÀNG QUÝ 1-2020
- 4. CHUYÊN ĐỀ: CÁCH THỨC MỚI THEO PHƯƠNG PHÁP BAYESIAN TRONG HIỆU CHỈNH LIỀU VANCOMYCIN THÔNG QUA NỒNG ĐỘ THUỐC TRONG MÁU.
- 4.1. Sơ lược về Vancomycin
- 4.2. Thông số PK/PD mục tiêu khi TDM Vancomycin
- 4.3. Đồng thuận về theo dõi nồng độ vancomycin của Hiệp hội Dược sĩ Y tế Hoa Kỳ (ASHP), Hiệp hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) và Hiệp hội Dược sĩ về các bệnh truyền nhiễm (SIDP) năm 2020 (16).
- 4.4 Thực tế hoạt động TDM vancomycin tại bệnh viện Bệnh Nhiệt đới
1. PHẢN ỨNG CÓ HẠI CỦA THUỐC (ADR):
A. Tổng kết công tác báo cáo ADR:
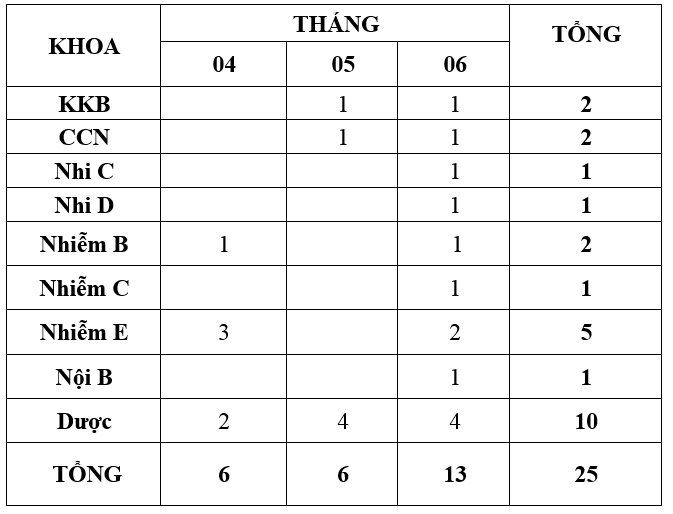
Quý 2-2020 ghi nhận có 25 báo cáo ADR xảy ra ở 9 khoa (theo bảng, giảm nhẹ so với Quý 1-2020 là 28 báo cáo). Trong đó khoa Dược (10 ca), Nhiễm E (5 ca), các khoa còn lại có báo cáo nhưng ít, tất cả đều được xử trí kịp thời. Trong 6 tháng đầu năm 2020, hiện có 06 khoa chưa có báo cáo ADR về khoa dược mặc dù thực tế theo dõi bệnh nhân có ghi nhận tác dụng phụ của thuốc (CCNL, KCC, Nhiễm V-A, Nội A). Đề nghị các khoa lâm sàng tích cực giám sát, theo dõi, xử trí và báo cáo tác dụng phụ không mong muốn thuốc gửi về khoa Dược trên phần mềm EHospital.
Phản hồi các khoa lâm sàng về chất lượng thuốc: không có
2. THÔNG TIN THUỐC, CẢNH GIÁC DƯỢC:
Xin xem thông tin phần Thông tin thuốc
3. KHUYẾN CÁO DƯỢC LÂM SÀNG QUÝ 1-2020
3.1. Tổng kết công tác giám sát và can thiệp dược lâm sàng:
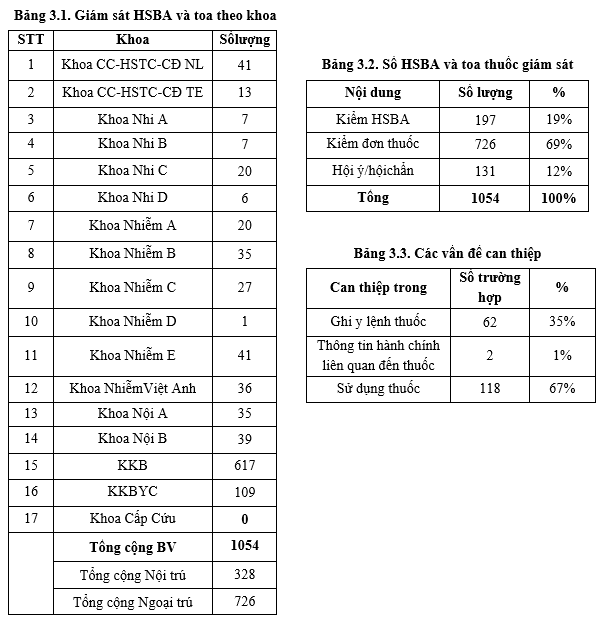
Công tác giám sát được thực hiện trên 328 HSBA nội trú và 726 toa thuốc ngoại trú (tăng so với Quý 1-2020 là 284 HSBA), điều chỉnh kiểm tra 7 HSBA/khoa vì một số khoa ít bệnh do tình hình dịch COVID-19. Ngoài ra, đơn vị dược lâm sàng cũng thực hiện 131 trường hợp hội ý/hội chẩn với các khoa lâm sàng trong quá trình điều trị tăng so với Quý 1/2020 (102 TH). Chủ yếu là hội chẩn về liều kháng sinh (vancomycin 40 ca, aminoglycosid 4 ca, colistin 19 ca), phối hợp kháng sinh và tư vấn về nguy cơ tác dụng bất lợi của thuốc,… Ngoài ra, DSLS can thiệp trực tiếp liều và điều chỉnh thuốc sử dụng; cảnh báo các nguy cơ tương tác thuốc các khoa lâm sàng khi duyệt y lệnh nội trú hàng ngày.
Đơn vị dược lâm sàng thực hiện 177 can thiệp (giảm nhẹ so với Quý 1/2020. Trong đó, có 95% trường hợp được thực hiện kịp thời chủ yếu là các can thiệp chỉnh liều và thông tin thuốc (tăng so với quý 1-2020 (91%). Trong Quý 2/2020, sự thống nhất ý kiến giữa dược lâm sàng và bác sĩ điều trị vẫn duy trì 99%, có 01 trường hợp đồng ý một phần về hiệu chỉnh liều kháng sinh khi suy thận.
3.2 Kết quả tiêu chí giám sát hồ sơ bệnh án, đơn thuốc và can thiệp DLS:
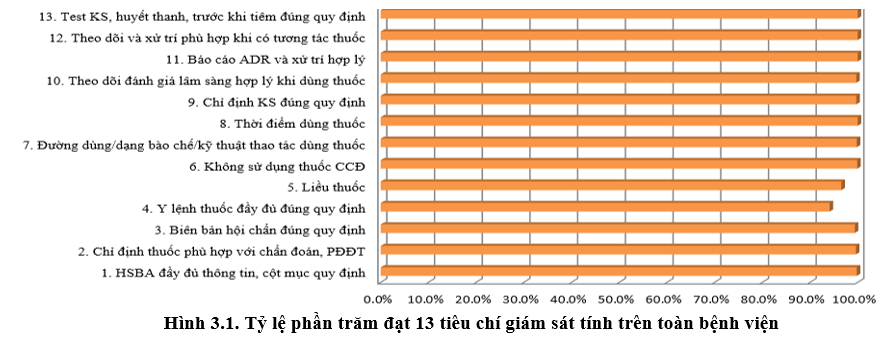
Toàn bệnh viện đạt 13 tiêu chí về sử dụng thuốc > 94% (Quý 1/2020 là 93%). Tiêu chí liều thuốc và y lệnh đầy đủ ở một số khoa CCNL, CCN, Nội B và Nhi C giảm nhẹ dao động khoảng 73-85%, BS tiến hành nạp y lệnh trực tiếp trên HIS nên còn sai trong thao tác nạp y lệnh. Khoa Dược ban hành liều thuốc dành cho Nhi và hướng dẫn liều Kháng sinh cập nhật 2020 hỗ trợ bác sĩ trong việc kê y lệnh về liều thuốc phù hợp.


3.3. Khuyến cáo dược lâm sàng:
- Thực hiện Yêu cầu Kháng sinh hạn chế bằng hệ thống FPT. Lưu ý các vấn đề sau:
o Phân tầng đúng nhóm nguy cơ đối với tất cả các trường hợp sử dụng kháng sinh bao gồm các kháng sinh đường uống (Nhiễm A). Khai thác kỹ tiền sử và các yếu tố nguy cơ của người bệnh để lựa chọn kháng sinh hợp lý. (Nhiễm B)
o Một số trường hợp còn thiếu KQ cận lâm sàng đề nghị các khoa lâm sàng thêm ý kiến và bổ sung kịp thời các kết quả để thuận lợi cho việc duyệt kháng sinh hạn chế được nhanh chóng, đúng thời gian quy định (KCC, Nhiễm E, A)
-
Nhập sai tên thuốc và y lệnh (KKBYC và KKB 20 đơn thuốc). Trong đó chủ yếu là nhập sai tên đọc gần nhau “sound alike” và sai số lượng thuốc.
-
Khi nạp y lệnh trên hệ thống HIS lưu ý kiểm tra y lệnh tránh trùng y lệnh. Nạp 2 lần cùng 1 y lệnh (Nội A, Nội B, Nhiễm B, CCNL, Việt Anh, Nhiễm E, sai số lượng – số lần dùng (Nội A, Nội B, Nhiễm A, Việt Anh, CCNL, Nhiễm E ), sai giờ y lệnh (Nội B, Nhiễm D).
-
Thiếu biên bản Hội chẩn/Phiếu kháng sinh hạn chế (CCNL).
-
Lưu ý đánh số thứ tự, ngày dùng thuốc đúng quy định của các thuốc kháng sinh, hướng thần và gây nghiện (CCNL). Ký rõ họ tên khi sửa y lệnh (Nhiễm B, Nhiễm VA)
-
Đề nghị BS các khoa LS ghi chẩn đoán và diễn biến lâm sàng trên “Màn hình ghi y lệnh” (Nhiễm C).
-
Khi BN có tiền sử dị ứng kháng sinh Khuyến cáo liên hệ DLS để lựa chọn thuốc hạn chế nguy cơ xảy ra phản ứng dị ứng.
-
Khuyến cáo chỉ định NTH, viêm phổi liều Oxacillin: 2g mỗi 4 giờ.
-
BN viêm gan C mạn/nấm da bội nhiễm, kê đơn: Fluconazol và Spulit (Itraconazol) Khuyến cáo: không dùng đồng thời (KKBYC)
-
BN 14 tuổi, ∆: viêm da cơ địa dị ứng. Rx: IMMULIMUS 0.1% (Tacrolimus 0.1%) (KKBYC). Theo NSX, CCĐ cho người < 16 tuổi. Khuyến cáo, TE > 2 tuổi: Tacrolimus 0.03%
-
Khuyến cáo liều các thuốc sau:
o Fostervita: (vitamin B1 100mg + vitamin B6 200mg+vitamin B12 200mcg). Theo khuyến cáo liều của NSX: 1 viên/ngày
o Bioflora 100mg: Người lớn và trẻ em: 2 gói mỗi ngày, chia làm 2 lần
o Dextromethorphan 15mg x 3 lần/ngày BN còn ho nhiều. Khuyến cáo chế độ liều của Dextromethorphan (DTQG, NSX)
• TE 2 - 6 tuổi: 2,5 - 5 mg mỗi 4 giờ, hoặc 7,5 mg mỗi 6 - 8 giờ, tối đa 30 mg/24 giờ.
• TE 6 - 12 tuổi: 5 - 10 mg mỗi 4 giờ/lần, hoặc 15 mg mỗi 6 - 8 giờ, tối đa 60 mg/24 giờ.
• NL và TE >12 tuổi: 10 - 20 mg mỗi 4 giờ, hoặc 30 mg mỗi 6 - 8 giờ, tối đa 120 mg/24 giờ
o Cefprozil 250mg/5ml: BN nhi 10kg, chẩn đoán viêm amidan cấp: 250mg q12h
• Trẻ từ 6 tháng tuổi: 7,5 -15mg q12h (Uptodate 2020)
• NSX, Uptodate khuyến cáo với chỉ định viêm amidan: 7,5mg/kg q12h.
o Ivermectin 6mg (Theo DTQG, NSX, PĐĐT của BV): 0,2mg/kg theo cân nặng bệnh nhân BN 85kg: 3 viên
o Tardyferon B9 (Sắt + Acid folic). Theo khuyến cáo liều của NSX: 1 viên/ngày.
o Khuyến cáo chỉ định điều trị Pseudomonas liều Ciprofloxacin: 400mg q8h
o Chẩn đoán: dị ứng da. Rx: Fexofenadin 180mg 1 viên x 2 lần/ngày và Ebastin 20mg 1 viên/ngày.
• Khuyến cáo Fexofenadin (Fegra 180mg) liều 180mg/ngày.
• Không phối hợp Fexofenadin + Ebastin
- Liều Esomeprazol cho điều trị dự phòng loét, GERD và viêm dạ dày không H.pylori là 20-40mg x 1 lần/ngày. Khuyến cáo TE <12 tuổi, cân nặng >30kg liều 20mg x 1 lần/ngày.
Tương tác thuốc:
-
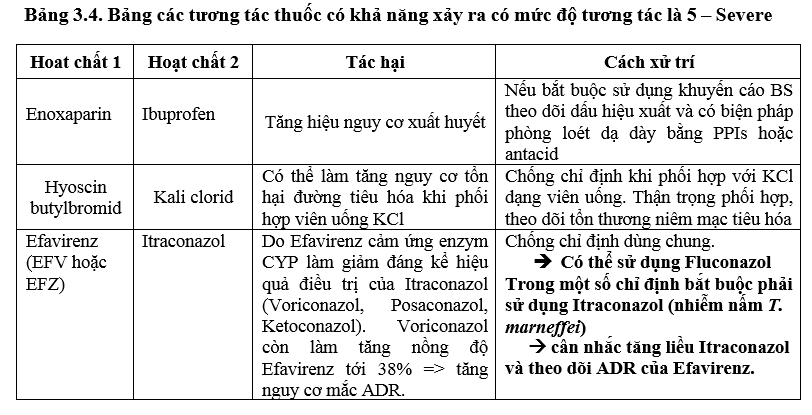
Trong Quý 2-2020, có 470 cảnh báo nguy cơ tương tác thuốc được can thiệp (DS NTBV: 157 ca; DLS: 299 ca; BS: 15 ca), chủ yếu là tư vấn và hướng dẫn người bệnh ngoại trú, điều chỉnh y lệnh khi duyệt toa nội trú (giảm nhiều so với Quý 1/2020). Lý do, các trường hợp can thiệp chỉ tiến hành ở mức độ 4, 5 và trong Quý 2 vẫn còn các bệnh nhân nặng nằm viện kéo dài, nguy cơ tương tác lặp lại mặc dù đã cảnh báo.
-
Các pDDI mức độ 5 có 06 ca và đã được cảnh báo + can thiệp. Chưa thấy tác dụng nguy cơ xảy ra thực trên người bệnh. Tuy nhiên, cần tích cực giám sát can thiệp để giảm các pDDI này trong thời gian tới.
- Khuyến cáo của Hội đồng thuốc và điều trị
Thực hiện Công số 1865/SYT-NVD ngày 01 tháng 04 năm 2020 về việc tăng cường giám sát tuân thủ phác đồ điều trị và quản lý chi phí sử dụng thuốc tại các bệnh viện. Hội đồng thuốc và điều trị đề ra Kế hoạch 05/HĐT&ĐTr – BVBNĐ ngày 22 tháng 04 năm 2020 theo khuyến cáo của Sở Y tế.
Sau khi họp với đại diện BHYT, cách ghi chỉ định, mô tả lâm sàng trong HSBA: Chú trọng khi bắt đầu, thay đổi dùng thuốc phải ghi đầy đủ chẩn đoán và mô tả lâm sàng để gợi ý sử dụng thuốc đúng chẩn đoán. Không cần lặp lại ở tất cả các ngày dùng thuốc. Ghi lộ trình dự kiến sử dụng (nếu được). Ví dụ: chẩn đoán viêm loét dạ dày dùng PPI, phải có mô tả triệu chứng gợi ý của chẩn đoán này ở ngày đầu tiên sử dụng. Cần thuyết minh tại sao tiếp tục dùng thuốc nếu khai thác có triệu chứng giảm hoặc sử dụng quá thời gian dự kiến dùng.
4. CHUYÊN ĐỀ: CÁCH THỨC MỚI THEO PHƯƠNG PHÁP BAYESIAN TRONG HIỆU CHỈNH LIỀU VANCOMYCIN THÔNG QUA NỒNG ĐỘ THUỐC TRONG MÁU.
4.1. Sơ lược về Vancomycin
Vancomycin được phát hiện từ một loại vi sinh vật Streptomyces orientalis, sản xuất ra một chất có khả năng kháng khuẩn đối với phần lớn các vi khuẩn Gram dương, kể cả các chủng Staphylococcus kháng penicillin bởi nhà hoá học Tiến sĩ E. C. Komfeld vào năm 1953. Các thử nghiệm trên động vật sau đó cho thấy “hợp chất 05865” có thể an toàn và hiệu quả ở người. Tuy nhiên, trước khi các thử nghiệm lâm sàng được bắt đầu, hợp chất còn được gọi là “Mississippi mud” vì màu nâu của nó, cần phải được tinh chế để tạo ra một chất sau đó gọi là Vancomycin (bắt nguồn từ “vanquish” – nghĩa là đánh bại)(5)
Vancomycin được coi là thuốc lựa chọn đầu tay trong điều trị MRSA. Tuy nhiên, xu hướng gia tăng sự xuất hiện của những chủng S. aureus dị kháng với vancomycin (hVISA) hay Staphylococcus aureus giảm nhạy cảm với vancomycin (vancomycin intermediate Staphylococcus aureus–VISA) dẫn đến những quan ngại về giảm khả năng đạt PK/PD mục tiêu và hiệu quả điều trị của thuốc6, 7. Khi sử dụng vancomycin cần thực hiện theo dõi nồng độ thuốc trong máu vì vancomycin có những vấn đề thuộc về bản chất của thuốc (VD: cửa số trị liệu hẹp) gây khó khăn trong đảm bảo hiệu quả và an toàn điều trị:
Nồng độ vancomycin cao có khả năng gây độc thận.
Nồng độ vancomycin trên bệnh nhân thực sự nhiễm MRSA thường chưa được tối ưu hoá dẫn tới thất bại điều trị.
4.2. Thông số PK/PD mục tiêu khi TDM Vancomycin
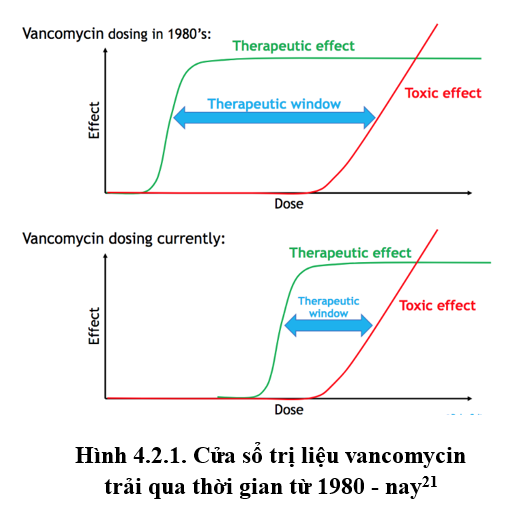
Cửa sổ trị liệu của vancomycin đã thu hẹp qua vài thập kỉ. Khi bắt đầu sử dụng vancomycin từ những năm 1980, nồng độ đáy mục tiêu là 5-10mg/l20. Theo thời gian, các chủng vi khuẩn đã giảm nhạy cảm với vancomycin trong điều trị. Việc gia tăng MIC của vi khuẩn gây giảm khả năng đạt chỉ số PK/PD mục tiêu và dẫn tới điều trị thất bại; quan trọng là làm tăng sự đề kháng của vi khuẩn4. Nhiều nghiên cứu khuyến cáo nồng độ đáy vancomycin trong máu dưới 10 mg/dL có thể là dự báo thất bại điều trị và nguy cơ xuất hiện VISA [13]. Để giải quyết vấn đề này, hướng dẫn về sử dụng vancomycin năm 2009 đã khuyến cáo nồng độ đáy mục tiêu là 15-20mg/l đối với nhiễm trùng nặng.
Như vậy sau gần 30 năm sử dụng, cửa sổ trị liệu của vancomycin thu hẹp lại, nồng độ đáy mục tiêu hiện tại khuyến cáo nằm trong khoảng phơi nhiễm độc tính so với năm 1980. Vi khuẩn tiến hoá mỗi ngày để kháng kháng sinh nhưng thận của người bệnh vẫn nhạy cảm với vancomycin như cũ.
Trên thực tế, nhiều nghiên cứu cho thấy nồng độ đáy 15mg/l là yếu tố nguy cơ gây độc tính trên thận (10). Do đó, các hướng dẫn về liều dùng của vancomycin trong điều trị do nhiễm khuẩn MRSA hiện nay chủ yếu dựa trên các khuyến cáo từ các nghiên cứu PK/PD trên nền tảng theo dõi nồng độ vancomycin trong máu (TDM vancomycin). Một phân tích tổng hợp của 9 nghiên cứu đoàn hệ đã so sánh kết quả lâm sàng ở bệnh nhân có tỷ lệ AUC/MIC cao và thấp (≥ 400 và < 400). Bệnh nhân có AUC/MIC cao có tỷ lệ tử vong thấp hơn đáng kể (RR 0,47; 95% CI: 0,31–0.70; p < 0,001). (11) Nhiều kết quả các nghiên cứu cũng cho thấy đáp ứng lâm sàng và đáp ứng vi sinh vượt trội ở những bệnh nhân đạt AUC0-24/MIC ≥ 400 (3,8,15). Đối với chủng MRSA có MIC 1, điều này ngụ ý rằng khi sử dụng vancomycin để điều trị bằng kháng sinh theo kinh nghiệm, chúng ta nên nhắm mục tiêu AUC0-24> 400 mg*h/L
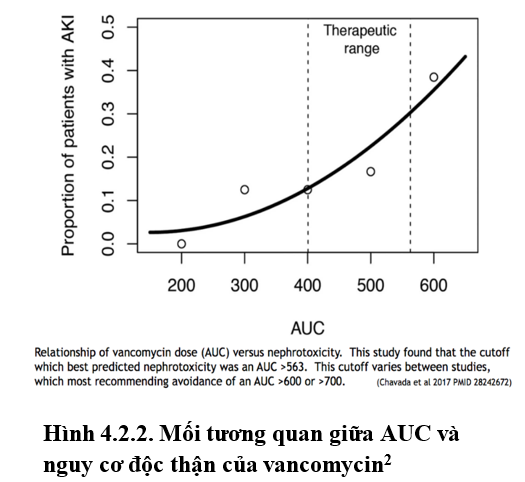
Bên cạnh đó, giới hạn ngưỡng tối đa AUC0-24/MIC có thể không gây độc thận chưa được nghiên cứu rõ ràng. Theo nghiên cứu của Chavada và cộng sự năm 2017, nguy cơ nhiễm độc thận tăng dần khi có giá trị AUC tăng. Nhìn chung, duy trì AUC0-24/MIC < 600mg*h/L có vẻ hợp lý để hạn chế nguy cơ độc thận của vancomycin (2). (Hình 4.2.2)
Tính toán AUC đòi hỏi một chút công phu, một cách tiếp cận đơn giản để đảm bảo hiệu quả lâm sàng AUC>400 là đạt nồng độ đáy mục tiêu 15mg/l. Mô phỏng dược động học minh hoạ mối quan hệ giữa nồng độ đáy và AUC18. Tuy nhiên, nó cũng thể hiện vấn đề khi nhắm nồng độ đáy mục tiêu 15-20mg/l có thể dẫn tới AUC sẽ cực cao trong một số trường hợp(20). (Hình 4.2.3)
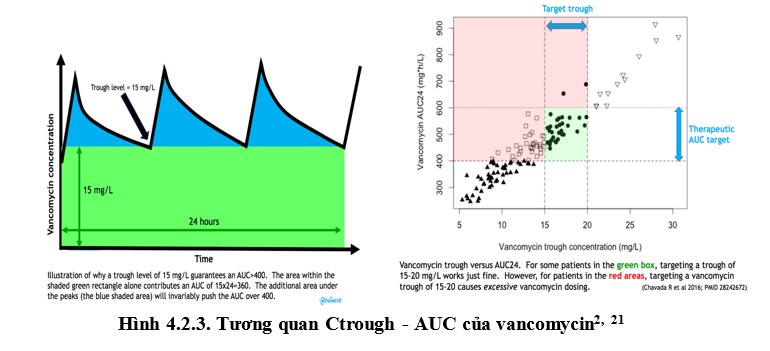
Trong bối cảnh đó, nồng độ đáy Ctrough đã được xác định có tương quan với AUC24h, do đó sử dụng nồng độ đáy để thay thế AUC được chấp thuận và khuyến cáo trong giám sát điều trị bằng vancomycin theo hướng dẫn theo dõi điều trị vancomycin đồng thuận của Hiệp hội Dược sĩ Y tế Hoa Kỳ (ASHP), Hiệp hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) và Hiệp hội Dược sĩ về các bệnh truyền nhiễm (SIDP) vào năm 2009 với khuyến cáo nồng độ Ctrough mục tiệu cần đạt được là 15 – 20 mcg/mL khi nhiễm khuẩn nặng do MRSA có MIC ≤ 1mg/L, nhằm đảm bảo AUC0-24/MIC mục tiêu ≥ 400(4,9). Đồng thời IDSA 2011 cũng khuyến cáo về nồng độ đáy Vancomycin:
Đo nồng độ đáy → giúp dự đoán AUC/MIC là cách thực tế và hữu dụng trong theo dõi vancomycin
-
Vancomycin trough <10 mcg/ml → tỷ lệ thất bại điều trị cao
-
Vancomycin trough ≥ 15mcg/ml: chưa thể hiện rõ ràng trong cải thiện điều trị, và tỷ lệ tử vong nhưng giúp giảm đề kháng.
Tuy nhiên, phương pháp theo dõi nồng độ đáy mục tiêu từ 15-20mg/l thể hiện nhiều khuyến điểm. Liều thông thường tính theo trọng lượng được khuyến cáo là 15mg/kg q12-8h và kiểm tra nồng độ đáy sau 3 liều. Có nhiều lý do khiến chiến lược này chưa, đặc biệt là những bệnh nhân ICU (20):
Thể tích phân phối (Vd) thường bất thường ở bệnh nhân ICU - đặc biệt là bệnh nhân bị quá tải dịch, bỏng, mang thai, béo phì, hoặc viêm hệ thống.
Một số bệnh nhân trong ICU trải nghiệm tăng thanh thải thận. Khi được điều trị bằng liều tiêu chuẩn của vancomycin thì nồng độ vancomycin thấp.
Nhiều bệnh nhân trong ICU bị tổn thương thận cấp, thường không được phản ánh chính xác bởi mức độ creatinine đo được (có thể mất vài ngày để mức độ creatinine cân bằng lại sau khi thay đổi chức năng thận). Những bệnh nhân này có nguy cơ tích lũy nồng độ vancomycin cao.
Vì những lý do trên, liều vancomycin ước tính thường sẽ sai. Chờ đến liều thứ tư để kiểm tra nồng độ đáy có thể khiến bệnh nhân nhận sai liều trong 48 giờ. Nếu vancomycin được dùng theo chiến lược thông thường ở những bệnh nhân nặng, bệnh nhân thường sẽ nhận được liều không đủ hoặc độc. Một nghiên cứu quan sát đa quốc gia cho thấy chỉ khoảng một nửa số bệnh nhân có nồng độ thuốc mục tiêu đạt được (1).
4.3. Đồng thuận về theo dõi nồng độ vancomycin của Hiệp hội Dược sĩ Y tế Hoa Kỳ (ASHP), Hiệp hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) và Hiệp hội Dược sĩ về các bệnh truyền nhiễm (SIDP) năm 2020 (16).
Đến đầu năm 2020, với hàng loạt các nghiên cứu được xem xét và đánh giá Hiệp hội Dược sĩ Y tế Hoa Kỳ (ASHP), Hiệp hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) và Hiệp hội Dược sĩ về các bệnh truyền nhiễm (SIDP) đồng thuận khuyến cáo việc theo dõi điều trị bằng thông số PK/PD là AUC/MIC thay vì nồng độ đáy theo hướng dẫn 2009. Giá trị AUC hàng ngày nên được duy trì trong khoảng từ 400 đến 600 mg*h/L để tối đa hóa hiệu quả và giảm thiểu khả năng tổn thương thận cấp.
Điểm khác biệt chính của Hướng dẫn theo dõi điều trị vancomycin đồng thuận của Hiệp hội Dược sĩ Y tế Hoa Kỳ (ASHP), Hiệp hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) và Hiệp hội Dược sĩ về các bệnh truyền nhiễm (SIDP) 2020 thể hiện trong Bảng 4.3.1.


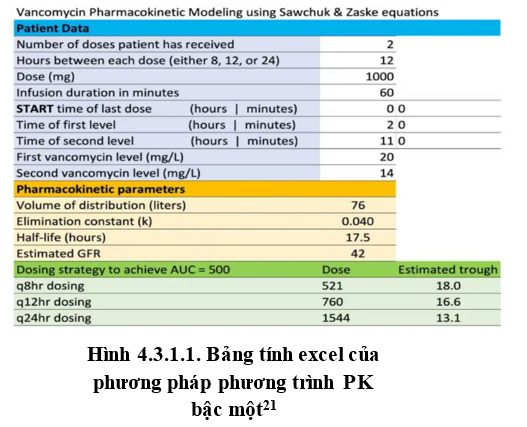
Phương pháp PK bậc một (tính theo công thức Sawchuk-Zaske)(16,21):
Mô hình dược động học dựa trên phương trình là một cách tiếp cận chính xác hơn. Liều dùng Vancomycin có thể được mô hình hóa bằng cách sử dụng mô hình một ngăn, trong đó vancomycin phân phối vào một ngăn duy nhất và sau đó được loại bỏ qua thận. Mô hình này tương đối hoạt động khá tốt, ngoại trừ vài giờ đầu sau khi dùng một liều vancomycin (tức là lúc thuốc đang được phân phối đến các mô). Hai điểm xác định đường cong phân rã theo cấp số nhân. Do đó, sử dụng mô hình một ngăn, cần có hai nồng độ thuốc để xác định dược động học của vancomycin. Điều này hơi tốn công sức hơn so với việc chỉ đo 01 nồng độ đáy, nhưng nó cung cấp nhiều thông tin hơn:
Thể tích phân bố (Vd) được đo (không được ước tính dựa trên trọng lượng của bệnh nhân). Điều này tránh các lỗi gặp phải ở những bệnh nhân đang mang thai, béo phì hoặc phù nề.
Hằng số loại bỏ (Ke) được đo. Điều này giúp loại bỏ sự mơ hồ của việc ước tính chức năng thận dựa trên mức độ creatinine ngẫu nhiên.
Đo các tham số này cho phép tính toán AUC của bệnh nhân.
Điều này đòi hỏi phải đo nồng độ vancomycin nhiều hơn. Ưu điểm là điều này cho phép nhắm mục tiêu ngay lập tức, cá nhân hóa điều trị. Toán học liên quan có thể được thực hiện bởi nhiều máy tính dược động học bao gồm bảng tính Microsoft Excel. Phương pháp này được bệnh viện khuyến cáo cho các đối tượng bệnh nhi, bệnh nhiễm trùng nặng tại các vị trí khó thấm cần nồng độ đỉnh cao hoặc thể tích phân bố (Vd) của bệnh nhân thay đổi (phù, tăng thanh thải, …).
4.3.2. Phương pháp theo mô hình Bayesian (16,21):
Phương pháp tính toán dược động học với việc sử dụng mô hình toán học Bayesian. Bắt đầu với cơ sở dữ liệu dân số liên quan đến các thông số dược động học với một số dữ liệu bệnh nhân (ví dụ: tuổi, giới tính, cân nặng, creatinine). Cơ sở dữ liệu này được sử dụng để tạo ra một mô hình máy tính dự đoán dược động học riêng lẻ. Ưu điểm chính của chiến lược Bayesian là giảm số lượng nồng độ vancomycin cần kiểm tra (ví dụ: đo hai nồng độ trong máu, có thể chỉ cần 01 nồng độ đáy). Tuy nhiên, phương pháp này cũng có một số hạn chế:
Thể tích phân bố thường được ước tính (không được đo trực tiếp).
Mô hình Bayesian được phát triển trong một dân số nhất định. Những mô hình như vậy có thể không phù hợp với các dân số khác chưa được khảo sát về thông số dược động học.
Có nhiều mô hình Bayesian khác nhau tồn tại, do đó, thành công đạt được với một mô hình Bayesian không đảm bảo rằng một mô hình Bayesian khác sẽ hoạt động.
Các mô hình Bayesian yêu cầu mua một chương trình máy tính nên thường không miễn phí. Điều này có thể tạo ra sự thiên vị ủng hộ Bayesian trong tài liệu (12,17)
Một nghiên cứu so sánh trực tiếp một chiến lược dựa trên phương trình PK bậc một với năm chương trình Bayesian cho thấy cách tiếp cận dựa trên phương trình PK bậc một là tương đương hoặc vượt trội so với các chương trình Bayesian (19)
4.4 Thực tế hoạt động TDM vancomycin tại bệnh viện Bệnh Nhiệt đới

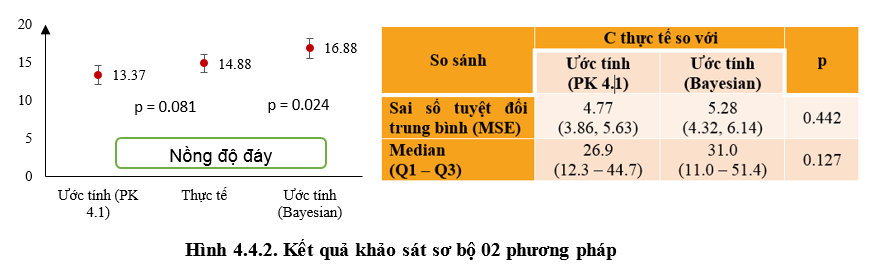
Bệnh viện Bệnh Nhiệt Đới thực hiện TDM vancomycin từ 2015 theo hướng dẫn năm 2009. Đến nay, đơn vị Dược lâm sàng - Bệnh viện Bệnh Nhiệt đới tiến hành khoả sát sơ bộ hồi cứu khoảng 103 bệnh nhân sử dụng vancomycin sử dụng theo hướng dẫn năm 2009 so với phương pháp Bayesian để ước tính liều. Kết quả cho thấy, phương pháp Bayesian dự đoán nồng độ đáy thường cao hơn so với giá trị Ctrough thực. Tuy nhiên, khi khảo sát khoảng sai lệch giữa Ctrough dự đoán và Ctrough thực đo thì không khác nhau giữa các phương pháp (Hình 4.4.2). Trên cơ sở đó, Hội đồng thuốc và điều trị thống nhất thay đổi quy trình theo dõi nồng độ vancomycin trong máu theo Hướng dẫn đồng thuận 2020.
Nguyên tắc
Đảm bảo đạt thông số AUC0-24/MIC= 400-600 mg•h/L cho nhiễm trùng MRSA (MIC≤ 1mg/l, không giảm liều khi MIC < 1mg/l), tốt hơn khi đạt được trong 24-48h.16
Khuyến cáo cách chính xác và tối ưu nhất để hiệu chỉnh liều vancomycin là thông qua giám sát AUC (A-II) bằng 1 trong 2 cách 16:
-
Đo hai nồng độ: nồng độ đỉnh – Cpeak (Cp) và nồng độ đáy – Ctrough (Ctr) ở trạng thái gần ổn định, tốt nhất là nên lấy 2 nồng độ này trong cùng một liều (nếu có thể) và sử dụng các phương trình PK bậc một để ước tính AUC (A-II người lớn; B-II trẻ em)(16)
-
Khuyến cáo tốt hơn khi dùng phần mềm ước tính Bayesian, đo một hoặc hai nồng độ vancomycin (có ít nhất một nồng độ đáy). Tốt hơn khi lấy hai nồng độ để ước tính AUC theo phương pháp Bayesian (A-II). Dùng 01 nồng độ đáy có thể đủ để ước tính AUC theo phương pháp Bayesian ở một số bệnh nhân nhưng cần nhiều dữ liệu hơn để xác định tính chính xác khi chỉ dùng 1 nồng độ (B-II)(16)
Phương pháp thực hiện:
-
Bác sĩ tính liều kinh nghiệm ban đầu để đảm bảo AUC/MIC đạt 400-600 trong 24-48h. Tính liều tải và liều duy trì ban đầu cho bệnh nhân (có thể dùng https://clincalc.com/Vancomycin/Beta.aspx)(20).
-
Bác sĩ/dược sĩ cân nhắc lựa chọn liều tùy theo lâm sàng và vị trí nhiễm trùng (viêm màng não mủ, viêm xương tủy).
-
Cân nhắc chọn Chế độ “Critically ill” khi đánh giá điểm APACHE II: 16-27 và/hoặc SOFA 7.6 ± 4 13, 20. Khi đó chế độ liều sẽ THẤP hơn chế độ liều “NON Critically ill” nếu sử dụng cách tính theo https://clincalc.com/Vancomycin/Beta.aspx
-
Tiến hành đo nồng độ thuốc, bác sĩ ghi rõ thời gian lấy mẫu máu đo nồng độ đỉnh/đáy vancomycin:
• Trẻ em: 01 nồng độ đỉnh và 01 nồng độ đáy ở trạng thái ổn định áp dụng theo PK bậc một để ước tính (Bảng tính PK Peds 2.0), mục tiêu chỉnh liều để đạt AUC/MIC= 400-600 mg*h/L).
• Người lớn: Sử dụng phương pháp Bayesian ước tính với 01 nồng độ đáy (Ctr) vancomycin. Cần tiến hành đo trong khoảng 24-48h kể từ dùng liều đầu tiên KHÔNG cần đợi thuốc đạt trạng thái ổn định. Thực hiện đo nồng độ đỉnh (Cp) khi hội chẩn cùng DLS trong nhiễm trùng nặng tại các vị trí khó thấm cần nồng độ đỉnh cao hoặc thể tích phân bố (Vd) của bệnh nhân thay đổi (phù, tăng thanh thải,…).
-
Bác sĩ đánh giá lâm sàng trong 24-48 giờ đầu sử dụng vancomycin. Nếu lâm sàng không cải thiện với AUC/MIC (MIC dự kiến = 1mg/l) trong khoảng 400-600mg*h/L cần hội chẩn DLS.
-
Điều dưỡng thực hiện lấy mẫu máu và ghi nhận GIỜ THỰC HIỆN lên phiếu yêu cầu xét nghiệm.
-
DLS hiệu chỉnh liều vancomycin khi có kết quả nồng độ vancomycin trong máu, cân nhắc lâm sàng của bệnh nhân và hội ý với bác sĩ điều trị để đảm bảo an toàn và hiệu quả.
• AUC0-24/MIC= 400-600 mg*h/L: Tiếp tục liều đang sử dụng.
• AUC0-24/MIC < 400 mg*h/L: Tăng liều vancomycin
• AUC0-24/MIC > 600 mg*h/L: Tạm ngưng liều kế tiếp, giảm liều vancomycin.
Kết luận:
Nói một cách công bằng, cách tiếp cận bằng phương pháp PK bậc một là công cụ miễp phí, linh hoạt và thích ứng với các tình huống (bệnh nhi, aminoglycosid, bệnh ICU có dược động học thay đổi). Cách tiếp cận dựa trên phương trình PK bậc một cung cấp phép đo thời gian thực của mức lọc cầu thận, có thể cung cấp thông tin hữu ích để phát hiện chấn thương thận cấp tính nhanh chóng. Ngược lại, cách tiếp cận Bayesian phù hợp cho những bệnh nhân ổn định hơn (ví dụ: bệnh nhân có mức độ creatinine ổn định) và giúp giảm số lượng đo nồng độ vancomycin trong quá trình TDM. Đồng thời, khi sử dụng để ước tính liều kinh nghiệm ban đầu nhằm đạt AUC mục tiêu trong 24-48h cho các tổng liều trong ngày thấp hơn và số lần dùng thuốc ít hơn. Nếu xét về mặt kinh tế thì phương pháp Bayesian có khả năng làm giảm chi phí điều trị cho bệnh nhân và tăng tính thuận lợi khi sử dụng thuốc mà vẫn đảm bảo được hiệu quả điều trị. Tuy nhiên, vấn đề đặt ra là cần phải có một mô hình Bayesian phù hợp với dân số tại bệnh viện để hạn chế các khuyết điểm của phương pháp. Điều này khá khó khăn và cần thời gian để tiến hành nghiên cứu về dược động học trên dân số tại bệnh viện, làm nền tảng dữ liệu xây dựng mô hình Bayesian thích hợp.
Sau khi cân nhắc các điều kiện hiện tại và các khảo sát hồi cứu, bệnh viện triển khai thực hiện Quy trình theo dõi nồng độ vancomycin trong máu năm 2020 theo hướng dẫn đồng thuận 2020 và sử dụng nguồn lực sẵn có trang web miễn phí theo phương pháp Bayesian: https://clincalc.com/Vancomycin/Beta.aspx. Bên cạnh đó, bệnh viện tiếp tục hợp tác tiến hành các đề tài nghiên cứu để đánh giá mô hình Bayesian đang thực hiện với các mô hình khác nhằm chọn lựa mô hình tối ưu phù hợp với dân số bệnh tại bệnh viện. Đồng thời trong tương lai gần sẽ thúc đẩy các nghiên cứu về thông số dược động học vancomycin của dân số Việt Nam từ đó xây dựng mô hình thích hợp nhất cho người Việt Nam.
Tài liệu tham khảo
1. Blot S, Koulenti D, Akova M, et al. Does contemporary vancomycin dosing achieve therapeutic targets in a heterogeneous clinical cohort of critically ill patients? Data from the multinational DALI study. Crit Care. 2014;18(3):R99
2. Chavada R, Ghosh N, Sandaradura I, Maley M, Van H. Establishment of an AUC0-24 Threshold for Nephrotoxicity Is a Step towards Individualized Vancomycin Dosing for Methicillin-Resistant Staphylococcus aureus Bacteremia. Antimicrob Agents Chemother. 2017;61(5)
3. Clin Pharmakinet 2004,43(13): 925-942
4. Dalovisio J. R., Levine D. P., Therapeutic monitoring of vancomycin in adults summary of consensus recommendations from the American Society of Health-System Pharmacists, the Infectious Diseases Society of America, and the Society of Infectious Diseases Pharmacists. Pharmacotherapy, 2009. 29(11): p. 1275-9
5. Griffith, R.S., Vancomycin use - an historical review. Journal off Antimicrobial Chemotherapy, 1984.
6. J., R.M., The pharmacokinetic and pharmacodynamic properties of vancomycin. Clin Infect Dis, 2006: p. 35-39.
7. Knollman B., C.B., et la., Goodman and Gilman’s the Pharmacological Basis of Therapeutics. McGraw-Hill Medical, 2011.
8. Le, J et al. Pediatr Infect Dis J 2013;32:e155-e162.
9. Liu C., B.A., et la., Clinical Practice Guidelines by te Infectious Diseases Society of America for the Treatment of Methicillin-Resistant Staphylococcus aureus Infections in Adults and Children. Clin Infect Dis, 2011. 52(3): p. 18-55.
10. Lodise T, Patel N, Lomaestro B, Rodvold K, Drusano G. Relationship between initial vancomycin concentration-time profile and nephrotoxicity among hospitalized patients. Clin Infect Dis. 2009;49(4):507-514
11. Men P, L.H., Zhai SD, Zhao RS, Association between the AUC0–24/MIC ratio of vancomycin and its clinical effectiveness: a systematic review and meta-analysis. 2016. 11(1).
12. Neely M, Kato L, Youn G, et al. Prospective Trial on the Use of Trough Concentration versus Area under the Curve To Determine Therapeutic Vancomycin Dosing. Antimicrob Agents Chemother. 2018;62(2).
13. Roberts JA, Taccone FS, Udy AA, et al. Vancomycin dosing in critically ill patients: robust methods for improved continuous-infusion regimens. Antimicrob Agents Chemother. 2011 Jun;55(6):2704-9
14. Rotschafer J, Crossley K, Zaske D, Mead K, Sawchuk R, Solem L. Pharmacokinetics of vancomycin: observations in 28 patients and dosage recommendations. Antimicrob Agents Chemother. 1982;22(3):391-394
15. Rybak M. J., L.B.M., Rotschafer J. C., Moellering R. C., Jr., Craig W. A., Billeter M., Stockmann Chris, R.J.K., et la, Vancomycin pharmacokinetic models: informing the clinical management of drug-resistant bacterial infections. Expert Review of Anti-infective Therapy, 2014.
16. Therapeutic monitoring of vancomycin for serious methicillin-resistant Staphylococcus aureusinfections: A revised consensus guideline and review by the American Society of Health-System Pharmacists, the Infectious Diseases Society of America, the Pediatric Infectious Diseases Society, and the Society of Infectious Diseases Pharmacists, Am J Health-Syst Pharm. 2020
17. Turner R, Kojiro K, Shephard E, et al. Review and Validation of Bayesian Dose-Optimizing Software and Equations for Calculation of the Vancomycin Area Under the Curve in Critically Ill Patients. Pharmacotherapy. 2018;38(12):1174-1183
18. Pai M, Neely M, Rodvold K, Lodise T. Innovative approaches to optimizing the delivery of vancomycin in individual patients. Adv Drug Deliv Rev. 2014;77:50-57
19. Neely M, Youn G, Jones B, et al. Are vancomycin trough concentrations adequate for optimal dosing? Antimicrob Agents Chemother. 2014;58(1):309-316