1. PHẢN ỨNG CÓ HẠI CỦA THUỐC (ADR):
A. Tổng kết công tác báo cáo ADR:
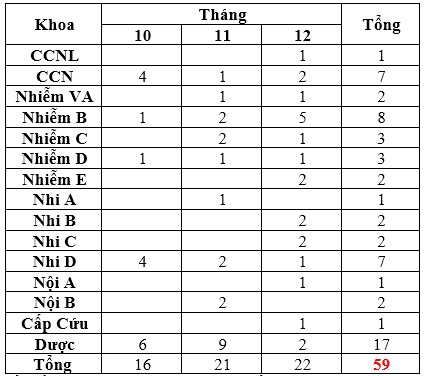
Quý 4-2023 ghi nhận có 59 báo cáo ADR xảy ra tại 15 khoa (theo bảng). Trong đó, khoa Dược báo cáo nhiều nhất với 17 ca, hầu hết là các trường hợp ngoại trú. So với 2 quý trước, báo cáo ADR Quý 4-2023 tăng cả về số ca và số lượng thuốc được báo cáo. Một số ADR mới ghi nhận là Linezolide (giảm tiểu cầu) và Voriconazole (ảo giác, mơ thấy ác mộng và mất ngủ). Các khoa lâm sàng tiếp tục tăng cường giám sát, theo dõi, xử trí và báo cáo tác dụng phụ không mong muốn của thuốc, đặc biệt lưu ý về các phản ứng khi truyền thuốc Amphotericin B.
Cân nhắc khi chuyển đổi kháng sinh cùng nhóm vì có thể xảy ra phản ứng chéo dù đó là phản ứng trên da niêm (phản vệ độ 1) qua trường hợp cụ thể: BN sử dụng Piperacilin/Tazobactam – bị nổi sẩn hồng ban ở thắt lưng, lan dần xuống nếp gấp gối, có kèm ngứa. Bệnh nhân có chỉ định chuyển Imipenem/Cilastatin nhưng ban da tiếp tục lan dần đến ngực, ngứa nhiều hơn. Sau đó, BN sử dụng levofloxacin có đáp ứng lâm sàng và triệu chứng dị ứng da giảm.
-> Hội ý với dược lâm sàng để có lựa chọn kháng sinh phù hợp khi bị dị ứng tránh tình trạng chuyển đổi kháng sinh nhiều lần và nặng thêm tình trạng dị ứng. Tham khảo Bản tin dược lâm sàng quý 1 năm 2020, phần chuyên đề “Tiếp cận bệnh nhân dị ứng kháng sinh”.
B. Phản hồi các khoa lâm sàng về chất lượng thuốc: không ghi nhận.
2. THÔNG TIN THUỐC, CẢNH GIÁC DƯỢC:
Xin xem phần Thông tin thuốc
3. KHUYẾN CÁO DƯỢC LÂM SÀNG QUÝ 4-2023
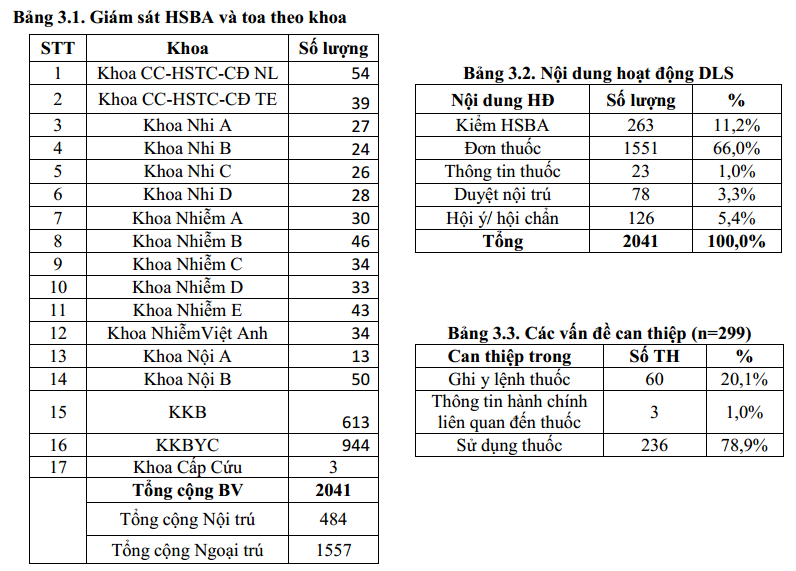
3.1. Tổng kết công tác giám sát và can thiệp dược lâm sàng:
Công tác giám sát được thực hiện trên 484 TH nội trú (giảm nhẹ so với quý 3/2023 là 498) và 1.557 toa thuốc ngoại trú (giảm nhẹ so với quý 2/2023 là 1853) do tình hình bệnh giảm. Đơn vị dược lâm sàng thực hiện 299 can thiệp dược lâm sàng chiếm 14.6% trong các hoạt động thường quy của DLS (giảm so với Quý 3/2023 là 15.7%). Chủ yếu là các can thiệp hội ý/hội chẩn về thuốc: liều kháng sinh (TDM voriconazol và linezolid, 96 ca vancomycin, tỷ lệ sử dụng vancomycin tăng so với Quí 3-2023,), phối hợp/lựa chọn kháng sinh và tư vấn về nguy cơ tác dụng bất lợi của thuốc,…và can thiệp trực tiếp khi duyệt nội trú y lệnh hàng ngày.
Trong 299 can thiệp có 78.9% là can thiệp trong việc sử dụng thuốc và giảm so với với Quý 3/2023. Quý 4/2023, sự thống nhất ý kiến giữa dược lâm sàng và bác sĩ điều trị tăng với quý 3/2023: 99%, có 02 trường hợp đồng ý một phần chủ yếu ở các khoa khám ngoại trú và NTBV. Tuy nhiên, tỷ lệ can thiệp kịp thời vẫn duy trì khoảng 86%, giảm nhẹ so với quý 3-2023. Dược sĩ lâm sàng cần tăng cường can thiệp, sâu sát hơn khi duyệt y lệnh nội trú và đi khoa.
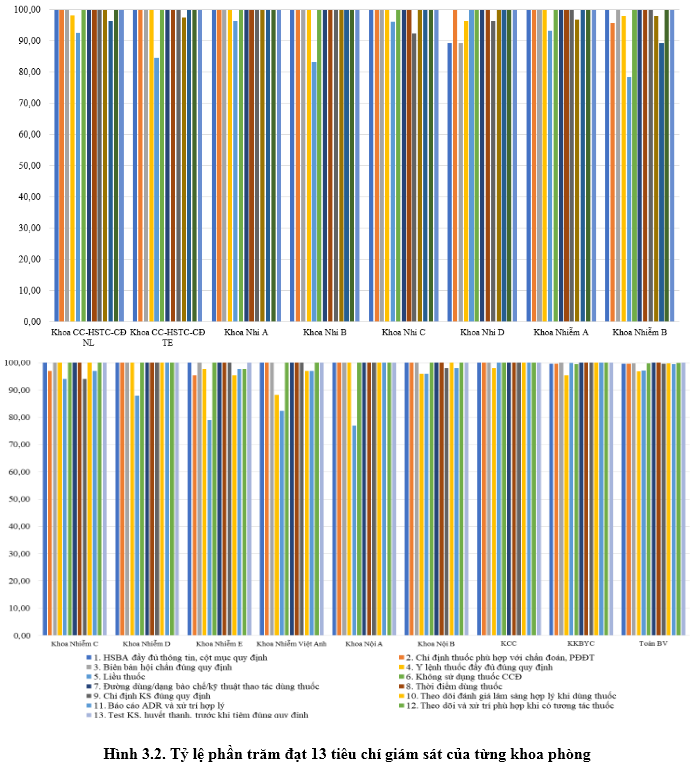
3.2. Kết quả tiêu chí giám sát hồ sơ bệnh án, đơn thuốc và can thiệp DLS:

Tiêu chí liều thuốc và y lệnh đầy đủ tăng so với Quý 3/2023. Các khoa thuộc Khối Nhi thực hiện các khuyến cáo về liều thuốc được cảnh báo có cải thiện. Đồng thời, các bác sĩ/điều dưỡng khi nạp y lệnh trên HIS cần chú ý để tránh trùng hoặc sai y lệnh, sai ngày giờ dùng thuốc, ở KKB và KKBYC trong Quý 4-2023 lỗi đánh máy giảm so với Quý 3-2023.
3.3. Khuyến cáo dược lâm sàng:
Quy chế kê đơn:
Khi nạp y lệnh trùng trên hệ thống HIS hoặc đánh nhầm số lượng, tên thuốc, trùng y lệnh; đặc biệt lưu ý khi choàng cử thuốc. Các sai sót này chưa xảy ra và ngăn chặn kịp thời tuy nhiên vẫn lặp lại sai sót trong Quý 3/2023 và có giảm so với quý trước. Khuyến cáo các khoa khám bệnh kiểm tra lại đơn thuốc.
Ví dụ:
• Sai dạng bào chế: 01 trường hợp
• Sai hàm lượng: 06 trường hợp
• Sai số lượng: 04 trường hợp
• Sai tên thuốc: 13 trường hợp
-
Kê đơn Eperison 50mg nhập Eprazinon 50mg
-
Kê đơn Enterogermina nhập Entecavir 0.5mg
-
Kê đơn EZVASTEN (Atorvastatin 20mg + Ezetimid 10mg) nhập Ezatux (eprazinon 50mg).
-
Kê đơn Eprazinon 50mg Nhập Eperison 50mg
-
Kê đơn Cetimed (cetirizine) Nhập Cetigam (Vitamin C )
-
Kê đơn Kali clorid 500mg Nhập KLAMENTIN 875/125 (Amoxicillin 875mg+Acid clavulanic125mg)
-
Kê đơn Liverplant (Silymarin 140mg) Nhập Livermarin (Silymarin 70mg)
-
Kê đơn GLESOZ 20mg (esomeprazol 20mg) Nhập GRITEROL 250mg (ursodeoxycholic acid 250mg)
-
Kê đơn Desloratadine/Genepharm (Desloratadin 5mg) Nhập BILAZIN 20 (Bilastin 20mg)
-
Kê đơn Domuvar (bacillus subtilis) Nhập Damagel suspension (almagate)
-
Kê đơn Eblamin (Silymarin 140mg+ Silybin 60mg) Nhập Ebastin 10mg
-
Kê đơn Envix 6 (Ivermectin 6mg) Nhập Entecavir 0.5 mg
Liều:
- Bệnh nhân 22t, 90 kg (cân nặng hiện tại 72 kg), 1m72. Chẩn đoán: Viêm phổi do P.aeruginosa, Corynebacterium striatum. Rx Piperacillin/Tazobactam 4.5 g q6h + Vancomycin 2g q12h (4g/ngày) truyền tĩnh mạch liên tục. Kết quả đo Css= 17.1 ug/mL. AUC/MIC ước tính = 17.1 x 24h = 410 ughr/mL (mục tiêu 400 - 600 ughr/mL), SCr = 32 umol/L, CrCl ~ 408 ml/phút (~ 320 ml/phút tính theo ABW), lâm sàng: Nội khí quản, thở máy, SpO2 98%/FiO2 30%.
-> Khuyến cáo tăng liều Vancomycin thành: 2.5g q12h, truyền tĩnh mạch liên tục trong 12h. Css đo lại = 18.1 ug/mL
- Bệnh nhân 36t, 69kg, 165cm. Chẩn đoán: Nhiễm trùng huyết S. aureus MRSA từ nhiễm trùng da; Áp xe ngoài màng cứng L1 S1. Rx Linezolid 600 mg q12h, kết quả đo nồng độ Linezolid Cmin (lấy sau 48h) dùng thuốc: Cmin= 1.6 ug/mL, SCr = 40- 45 106 131 149 124 umol/L (xu hướng giảm), CrCl cải thiện. *Vấn đề: Cmin < 2 ug/mL, lâm sàng cải thiện (WBC giảm), tiểu 4.5 L/ngày, bệnh cảnh abces ngoài màng cứng, dự kiến KS dài ngày + hội chẩn lại ngoại khoa, tiểu cầu không giảm
-> Khuyến cáo tăng liều Linezolid thành 600 mg q8h, Cmin dự kiến ~ 3 ug/mL. Đo kiểm tra lại Cmin sau 48h (tính từ khi bắt đầu liều mới). Theo dõi SCr + công thức máu mỗi ngày để theo dõi chức năng thận + độc tính trên huyết học với Linezolid trong 48h tiếp theo.
Bệnh nhân, 85t 160cm, 83kg. Chẩn đoán: Suy hô hấp - Viêm phổi do cầu trùng gram dương, cấy BAL (+) thấy khúm tụ cầu. Rx Linezolid 600 mg q12h, kết quả đo Cmin = 10 ug/mL. Bệnh nhân có bệnh lý huyết học (đã hội chẩn huyết học nhưng người nhà không đồng ý điều trị thêm). Chức năng thận CrCl ~ 40 - 50 ml/phút ml/phút. -> Khuyến cáo chỉnh liều Linezolid thành: 600 mg q24h, Cmin dự kiến ~ 5 ug/mL. Đo kiểm tra lại sau 48h. Lưu ý khi TDM Linezolid:

BN nam72t. Chẩn đoán: TD Herpes môi. Rx Acyclovir 200mg x 3 lần/ngày
-> Khuyến cáo Acyclovir 400mg q8-12h cho trường hợp Herpes da niêm
CĐ vảy nến dùng Clorpheniramin 4mg x 4 lần/ngày
-> Khuyến cáo liều cho trẻ 6-12 tuổi tối đa 12mg/ngày
BN dùng Tigecyclin 01 ngày LD 100ng, 50 mg q12h (tức 01 cử 100mg và 01 cử 50mg).
-> BN Bệnh não gan - Xơ gan mất bù Child C khuyến cáo liều Tigecyclin 25mg q12h.
Bệnh nhân Rx Voriconazol IV 400 mg q12h N1, từ N2 200 mg q12h do nhiễm Aspergillus xâm lấn mũi xoang, hoại tử xương hàm trên. CN gan khi khởi trị trong giới hạn bình thường. Sau 1 tuần điều trị ghi nhận GGT tăng lên 700 sau đó 1300 1900; AST/ALT tăng nhẹ (<2 ULN). Bệnh nhân không có tiền sử bệnh gan nền/sử dụng thuốc ảnh hưởng CN gan
-> GGT tăng nên giảm liều Voriconazol còn 2/3 liều ban đầu. Đo nồng độ đáy Voriconazol = 3,67mg/l (C mục tiêu người Châu Á Cmin = 1-4mg/l). Tuy nhiên, GGT tiếp tục tăng (1900) Khuyến cáo giảm còn ½ liều ban đầu (PO). BN ổn xuất viện và tái khám sau 01 tuần, đánh giá lại CN gan + lâm sàng
BN nữ, 74 tuổi, 40kg, 136cm, CrCl 59 ml/phút TD Viêm phổi do Candida spp Cấy BAL + nước tiểu ra Candida albicans đa nhạy. Bác sĩ hội chẩn liều Fluconazol IV.
-> Theo Dược thư quốc gia 2022, Uptodate và Phác đồ điều trị nấm xâm lấn BYT, liều Fluconazole TTM 6mg/kg/ngày (Phần thuốc dư hủy), tốc độ truyền tối đa 10ml/phút.
Bệnh nhân nam, 39t, 74 kg, 164 cm. Chẩn đoán: Nhiễm trùng huyết do E.faecium; Đợt bùng phát Viêm gan siêu vi B mạn HBeAg âm - Suy gan (ổn); Bệnh não gan độ 1; TD Xơ gan do rượu; Rối loạn điện giải; Trào ngược dạ dày thực quản. Rx Linezolid 600 mg q12h. Kết quả đo nồng độ Linezolid Ctrough = 25.287 ug/mL. SCr = 112 umol/L, CrCl ~ 82 ml/phút, PLT 88 100 116 K/uL. *Vấn đề: Ctrough mục tiêu với Linezolid 2-7 ug/mL; lâm sàng nhiễm trùng hiện ổn
-> Khuyến cáo: Tạm ngưng (thời gian tạm ngưng ước tính theo T1/2 và nồng độ đo được so với mục tiêu). Giảm liều thành: 600 mg q24h hoặc 450 mg q12h + theo dõi công thức máu để đánh giá ADR trên huyết học của Linezolid.
Bệnh nhân nữ, 21t, 48 kg, 157cm. Chẩn đoán: Viêm phổi thùy. Rx Vancomycin 1 g q8h (62.5 mg/kg/ngày), kết quả đo nồng độ Vancomycin đáy: Ctrough = 7.2 ug/mL, SCr = 41 umol/L (CrCl ~ 140 – 160 ml/phút) . Bác sĩ hội chẩn DLS về hiệu chỉnh liều Vancomycin Vấn đề: AUC24h ước tính < 400ughr/mL
-> Khuyến cáo chuyển sang chế độ truyền liên tục Vancomycin – CI-V (tổng liều > 60 mg/kg/ngày và CrCl > 130 ml/phút). Liều 60 mg/kg/ngày ~ 3g q12h chia làm 2 cử, mỗi cử 1.5g q12h truyền tĩnh mạch liên tục. Lấy mẫu đo Css sau 18h tính từ khi bắt đầu CI-V, kết quả Css = 22 ug/mL ~ AUC24h = Css x 24 = 528 ug*hr/mL
Sử dụng thuốc:
- Bệnh nhân 63 kg, 163cm. Chẩn đoán: TD quá tải dịch - tổn thương thận cấp có nước tiểu/ Sốt xuất huyết Dengue nặng. SCr ~ 720 - 740 umol/L. Hội chẩn chuyên khoa nội thận đề nghị truyền Natri Bicarconate 1.4%. *Vấn đề: Hiện khoa Dược chỉ có 2 chế phẩm: 1) Natri Bicarcobate 8.4%, ống 10 mL; 2) Natri Bicarbonate 4.2 %, chai 250 mL. Bác sĩ hỏi cách pha để có dung dịch Natri Bicarbonate 1.4% (cần 500 mL)?
-> Hướng dẫn cách pha 500 mL dung dịch Natri Bicarbonate 1.4% từ dung dịch mẹ Natribicarbonate 8.4% ống 10mL như sau:
(1) Lấy chai dung môi NaCl 0.9 %, hoặc Glucose 5% 500 mL, rút bỏ 80 mL
(2) Lấy 8 ống Natri Bicarbonate 8.4%, mỗi ống 10 mL lần lượt cho vào (1), đảo trộn nhẹ nhàng, quan sát dung dịch sau pha loãng đảm bảo: trong suốt, không màu, không tiểu phân/hạt lơ lửng. Tổng thể tích dung dịch sau pha loãng đảm bảo ~ 500 mL .
(3) Lưu ý: Dung dịch sau pha loãng cần sử dụng ngay, không pha chung hoặc truyền chung hoặc sử dụng chung bộ dụng cụ với dung dịch có chứa Canxi, Magie, Phosphate. (Tài liệu tham khảo: NSX).
- Bệnh nhân 82kg, 180cm. Chẩn đoán: Viêm phổi suy hô hấp; PCP; Lao phổi + tiêu hóa + máu; Nhiễm trùng vết thương do Pseudomonas aeruginosa; Nấm thực quản; Nhiễm Mpox; AIDS; Trào ngược dạ dày thực quản; Phù (R60.1). Cân bằng xuất nhập: Vnhập = 3080 mL/ngày; Xuất = 2000 mL (nước tiểu). Hiện Rx Vancomycin 2g/500mL NaCl 0.9% truyền liên tục q12h; Imipenem/Cilastatin 500 mg/100 mL NaCl 0.9% q6h. *Vấn đề: V (mL) nhập > V (mL) xuất ~ 1000 mL/ngày; bệnh nhân phù Cần hạn chế Thể tích dịch nhập/24h.
-> Khuyến cáo pha hạn chế dịch với kháng sinh như sau: 1) Vancomycin 2g pha trong 300 mL NaCl 0.9 % (nồng độ Vancomycin truyền tĩnh mạch là: 6.7 mg/mL) truyền tĩnh mạch liên tục q12h Ước tính giảm 400 mL/24h
2) Imipenem/Cilastatin 500 mg pha trong 50 mL NaCl 0.9%, truyền tĩnh mạch trong ít nhất 60 phút Ước tính giảm 200 mL/24h V (mL) dịch giảm ước tính 600 mL q24h (Tài liệu tham khảo: Minimum Infusion Volumes For fluid restricted critically ill patients, Fourth Edition (2012).
- Bệnh nhân hạ Kali máu cần Rx Kali clorid 10% đường tiêm truyền tĩnh mạch, hiện tại [K+] máu = 3.2 mmol/L, [Na+] =145 mmol/L, [Cl-] = 115.3 mmol/L. Bác sĩ hỏi DLS Kali clorid 10% pha trong NaCl 0.45 % được không? *Vấn đề: Bệnh nhân hạ kali máu cần bù nhưng hiện natri máu tăng cần hạn chế lượng natri đưa vào.
-> Theo [1] ASHP® Injectable Drug Information™, [2] Potassium chloride. Australian Injectable Drugs Handbook, 8th Edition Accessed on 15 September 2020. 2020. Kali clorid 10% tương hợp với dung môi: Sodium chloride 0.9%, sodium chloride 0.45%, Hartmann’s, Ringer’s Căn cứ theo tình huống lâm sàng của bệnh nhân, có thể pha loãng KCl 10% bằng dung môi NaCl 0.45%
Bệnh nhân 11 tuổi, chẩn đoán chàm da, dị ứng, Bs kê đơn Tacrolimus 0.1%. Theo NSX và DTQG, Tacrolimus 0.1% dùng cho bệnh nhân từ 15 tuổi trở lên.
-> Khuyến cáo Bs chuyển sang dùng Tacrolimus 0.03% có chế độ liều cho trẻ ≥ 2 tuổi trở lên
Bệnh nhân 14 tuổi, 43kg, chẩn đoán tăng men gan, sốt xuất huyết ổn. Bs kê đơn Livosil silymarin 140mg): 1 viên x 2 lần/ngày. Theo NSX, Livosil chống chỉ định cho bệnh nhân dưới 18 tuổi
-> Báo Bs điều chỉnh, chọn thuốc khác không chống chỉ định cho trẻ em (Silymax complex, Silybean, Hepanic-extra, Eblamin)
Bệnh nhân 84t, 50kg, 155cm. Chẩn đoán: Nhiễm trùng huyết; Viêm phổi do Achromobacter xylosoxidans; Nhiễm trùng tiểu do E.faecium và Candida spp; Tổn thương thận cấp/Bệnh thận mạn giai đoạn cuối. CrCl ~ 22 ml/phút. Vấn đề: Bệnh nhân Rx Linezolid 600 mg q12h N5, ghi nhận giảm tiểu cầu: 90 --> 69 K/uL. Kết quả đo nồng độ Linezolid: Ctrough = 42.6 ug/mL. CrCl < 30 ml/phút. Dự kiến tiếp tục kháng sinh.
-> Khuyến cáo Linezolid sử dụng trên BN suy thận có thể dẫn tới nồng độ thuốc tăng. Thời gian bán thải (T1/2) Linezolid với bệnh nhân có chức năng thận bình thường là 5h; với bệnh thận mạn giai đoạn cuối là 6-8h (và có thể kéo dài hơn) (Sanford Guide). Bệnh nhân thuộc nhóm đối tượng khuyến cáo nên TDM và nên thực hiện sớm (sau 48h tính từ khi bắt đầu Rx).
Bệnh nhân 51t, 65kg, 163cm. Chẩn đoán: Nhiễm trùng huyết cầu trùng gram dương; Viêm mô tế bào chân (P) + tay (P); Nhiễm trùng vết thương chân (P); Đái tháo đường type 2; Cushing do thuốc. Cấy máu (+) MRSA (MIC <= 0.5). Vấn đề: Bệnh nhân Rx Vancomycin, đã tối ưu hóa chế độ liều Vancomycin: Cđáy = 18.2 24.4 17.9 ug/mL. AUC24h đảm bảo mục tiêu từ 500 – 600 ughr/mL, tổng liều dao động từ 4-4.5g/ngày. Cấy máu 4 lần dương tính liên tiếp. Lâm sàng đáp ứng chậm.
-> Do chưa loại trừ viêm nội tâm mạc nhiễm trùng + nhiễm trùng vùng cơ xương khớp cột sống Hội chẩn VSLS + DLS khuyến cáo phối hợp Rifampicin (liều 300mg/8h) (KSĐ nhạy), liên hệ lại vi sinh làm xét nghiệm tìm hVISA đồng thời điều trị phối hợp Vancomycin + Rifampicin, cấy mấu lần 5, 6 âm tính.
Bệnh nhân nằm viện dài ngày, 48 kg, 148cm, 95t. Cấy nước tiểu (+) K.pneumoniae đa kháng còn nhạy Colistin (MIC <=0.5 - Vitek). SCr = 48 umol/L. Bác sĩ hội chẩn về việc sử dụng Colistin rửa bàng quang cho bệnh nhân. Bệnh nhân đã sử dụng nhiều loại kháng sinh trước đó
-> Tham khảo khuyến cáo từ các báo cáo ca lâm sàng về việc rửa bàng quang, khuyến cáo liều Colistin rửa bàng quang: Colistin 1 MUI pha trong 500 mL NaCl 0.9% q8h, bơm rửa bàng quang liên tục.
Do BN lớn tuổi, thể tích bàng quang giảm nên giảm thể tích pha còn 250 mL NaCl 0.9%. Dự kiến KS trong 5-7 ngày tùy theo đáp ứng lâm sàng của bệnh nhân.
Bệnh nhân Rx Amphotercin B phức hợp lipid: 6 lọ/ngày. Hiện bệnh nhân phù, cần hạn chế dịch. Bác sĩ hỏi nồng độ tối đa được phép pha của Amphotericin B?
-> Khuyến cáo cách pha Amphotercin B phức hợp lipid: Cần hạn chế dịch với nồng độ tối đa không vượt quá 2mg/mL Với liều 6 lọ x 50 mg/lọ = 300 mg q24h Thể tích dung môi tối thiểu cần pha loãng là 150 - 200 mL Glucose 5%.
BN Nhiễm trùng huyết do B.pseudomallei Điều trị Imipenem 1g/8h, pha 2 lọ với 200ml, BN than mệt khi truyền gần xong BS hỏi có thể giảm thể tích truyền thuốc.
-> Mỗi 500mg imipenem có thể pha với tối thiểu 60ml 1g imipenem pha 120ml, quan sát pha thuốc đảm bảo tan hoàn toàn, không lợn cợn
TD Nhiễm nấm Aspergilus xâm lấn mắt, đa xoang bội nhiễm - Loét giác mạc trái - Đái tháo đường type II: voriconazol 400mg x 2 lần/ngày. BN báo mất ngủ, ảo giác vài ngày gần đây. Kết quả đo voriconazol Cmin=3.215 mcg/ml (Mục tiêu Cmin = 1-4 ug/mL – người châu Á)
-> DLS đã trao đổi với bệnh nhân, hiện không còn tình trạng trên 2 ngày, nồng độ thuốc đạt mục tiêu điều trị tiếp tục giữ liều hiện tại đồng thời theo dõi, ghi nhận các biểu hiện nghi ngờ do voriconazol.
Bệnh nhân 70t, CrCl < 10 ml/phút. Chẩn đoán: THA Rx Nifedipine 20 mg retard 1.5 viên x 2 lần ngày. *Vấn đề: Chế phẩm dạng bào chế phóng thích trì hoãn, việc bẻ đôi hoặc phá vỡ cấu trúc viên thuốc (nhai, bẻ, nghiền, ngậm) sẽ làm ảnh hưởng đến đặc tính phóng thích của thuốc Thay đổi hiệu quả điều trị THA
-> Khuyến cáo: 1) Uống nguyên viên, không nhai, bẻ, nghiền, ngậm hoặc làm vỡ viên thuốc, uống với nước; 2) Liều khuyến cáo trong điều trị THA: 1 viên (20 mg) x 2 lần/ ngày hoặc có thể tăng 2 viên x 2 lần/ngày hoặc liều từ 20 - 100 mg dùng 1 lần/ngày. Khoảng cách tối thiểu giữa 2 lần uống thuốc là 12h (NSX)
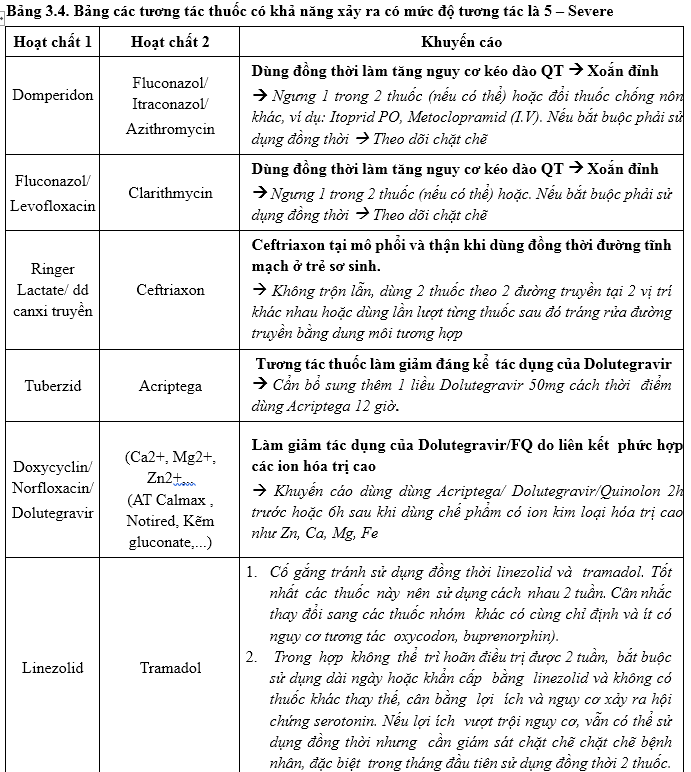
Tương tác thuốc:
Hoàn thiện cảnh báo mức độ 5 và nội dung ghi chú can thiệp của bác sĩ và DLS trên y lệnh Ehospital theo Quyết định 5948/QĐ-BYT.

Khuyến cáo Hội đồng thuốc và điều trị - Ban Quản lý sử dụng kháng sinh
Ban QLSDKS thực hiện giám sát HSBA sử dụng kháng sinh tại khoa Nhiễm B tháng 10 (103 bệnh nhân tương ứng 104 đợt điều trị) và có những khuyến cáo sau:
-
Ghi nhận Chiều cao - cân nặng đầy đủ.
-
Tỷ lệ không phân tầng/phân tầng không hợp lý khá cao 20%, chủ yếu không thực hiện phân tầng với KS đường uống. Nội dung các yếu tố nguy cơ chưa đúng so với bệnh sử ghi trong hồ sơ. Thiếu khai thác thông tin dẫn đến phân tầng sai.
-
Cấy VS 91%, tỷ lệ cấy (+) 18%. 01 ca cấy ngoại nhiễm Staphylococcus pyrogens
-
Tỷ lệ sử dụng KS khởi đầu không hợp lý 9%, không sử dụng khởi đầu là 1%.
-
69% có đánh giá lâm sàng sau 48-72h; 76% đánh giá LS khi kết thúc đợt điều trị. Tỷ lệ này còn thấp cần cải thiện.
-
Về hiệu quả điều trị 88% tốt, chuyển viện 1%. Tỷ lệ có KSĐ 18%, 03/17 TH không nhạy với KSBĐ trong đó 02 ca xuất viện hiệu quả điều trị tốt.
-
Tỷ lệ dùng KS phối hợp là 45% khá cao, tỷ lệ Xuống thang kháng sinh: 10%
-
Thời gian dùng KS: LOT trung bình 8,33 ngày. Phối hợp KS nhiều nên DOT trung bình là 10,37. Thời gian dùng KS còn dài, cân nhắc ngưng KS sớm khi có thể. (Có ca hết sốt 8 ngày mới ngừng KS, trong khi hết sốt 4 ngày sau dùng KS và XQ phổi cải thiện)
-
Vấn đề trong phối hợp: Phối hợp nhiều với azithromycin nhưng không ghi rõ lý do; Dùng KS ban đầu điều trị viêm mô tế bào phối hợp Pip-taz+linezolide không cần thiết vì không có cơ địa hướng gram (-)
-
Làm phiếu KS sau 7N cần giữ nguyên nhóm phân tầng nguy cơ ban đầu.
-
Chú ý liều Vanco TDM mục tiêu AUC> 400; điều chỉnh lại liều Imipenem sau khi không còn nghĩ nhiễm trùng Burkhold
-
Có mộc đánh giá đáp ứng KS tuy nhiên chưa được sử dụng phổ biến.
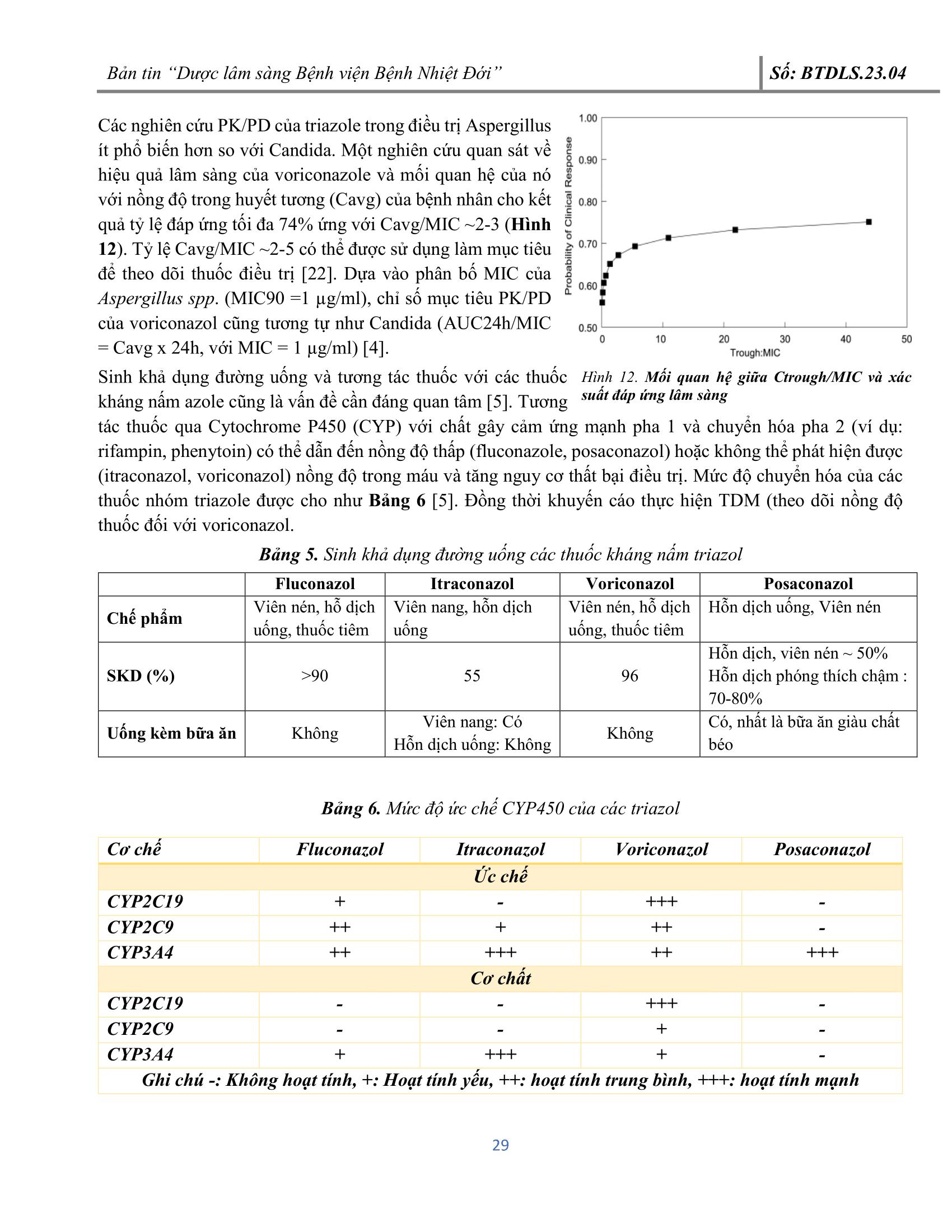
4. CHUYÊN ĐỀ: ĐẶC ĐIỂM DƯỢC ĐỘNG – DƯỢC LỰC HỌC (PK/PD) CÁC THUỐC KHÁNG NẤM VÀ ỨNG DỤNG TRONG THỰC HÀNH LÂM SÀNG TẠI BỆNH VIỆN BỆNH NHIỆT ĐỚI:












DS. Đặng Hửu Lể - Đơn vị TTT-DLS BVBNĐ
TÀI LIỆU THAM KHẢO
[1] Bộ Y Tế, “‘Hướng dẫn chẩn đoán và điều trị nhiễm nấm xâm lấn,’” Ban hành kèm theo Quyết định số 3429/QĐ-BYT ngày 14 tháng 07 năm 2021), 2021, [Online]. Available: https://emohbackup.moh.gov.vn/publish/home?documentId=8490
[2] F. Bongomin, S. Gago, R. O. Oladele, and D. W. Denning, “Global and multi-national prevalence of fungal diseases—estimate precision,” J. Fungi, vol. 3, no. 4, 2017, doi: 10.3390/jof3040057.
[3] A. Borst, “In search of the holy grail of fly motion vision,” Eur. J. Neurosci., vol. 40, no. 9, pp. 3285–3293, 2014, doi: 10.1111/ejn.12731.
[4] W. Hope and D. R. Andes, “Antifungal Pharmacokinetics and Pharmacodynamics,” Methods Pharmacol. Toxicol., pp. 369–383, 2016, doi: 10.1007/978-1-4939-3323-5_15.
[5] R. E. Lewis, “Current concepts in antifungal pharmacology,” Mayo Clin. Proc., vol. 86, no. 8, pp. 805–817, 2011, doi: 10.4065/mcp.2011.0247.
[6] F. B. Cavassin, J. L. Baú-Carneiro, R. R. Vilas-Boas, and F. Queiroz-Telles, “Sixty years of Amphotericin B: An Overview of the Main Antifungal Agent Used to Treat Invasive Fungal Infections,” Infect. Dis. Ther., vol. 10, no. 1, pp. 115–147, 2021, doi: 10.1007/s40121-020-00382-7.
[7] R. J. Hamill, “Amphotericin B Formulations : A Comparative Review of Efficacy and Toxicity Amphotericin B Formulations : A Comparative Review of Efficacy and Toxicity,” no. July, 2018, doi: 10.1007/s40265-013-0069-4.
[8] D. Andes, T. Stamsted, and R. Conklin, “Pharmacodynamics of amphotericin B in a neutropenic-mouse disseminated-candidiasis model,” Antimicrob. Agents Chemother., vol. 45, no. 3, pp. 922–926, 2001, doi: 10.1128/AAC.45.3.922-926.2001.
[9] N. P. Wiederhold, V. H. Tam, J. Chi, R. A. Prince, D. P. Kontoyiannis, and R. E. Lewis, “Pharmacodynamic activity of amphotericin B deoxycholate is associated with peak plasma concentrations in a neutropenic murine model of invasive pulmonary aspergillosis,” Antimicrob. Agents Chemother., vol. 50, no. 2, pp. 469–473, 2006, doi: 10.1128/AAC.50.2.469-473.2006.
[10] I. Bekersky, R. M. Fielding, D. E. Dressler, J. W. Lee, D. N. Buell, and T. J. Walsh, “Pharmacokinetics, excretion, and mass balance of liposomal amphotericin B (AmBisome) and amphotericin B deoxycholate in humans,” Antimicrob. Agents Chemother., vol. 46, no. 3, pp. 828–833, 2002, doi: 10.1128/AAC.46.3.828-833.2002.
[11] R. Al-Saigh, M. Siopi, N. Siafakas, A. Velegraki, L. Zerva, and J. Meletiadis, “Single-dose pharmacodynamics of amphotericin b against aspergillus species in an in vitro pharmacokinetic/pharmacodynamic model,” Antimicrob. Agents Chemother., vol. 57, no. 8, pp. 3713–3718, 2013, doi: 10.1128/AAC.02484-12.
[12] O. A. Cornely et al., “Liposomal amphotericin B as initial therapy for invasive mold infection: a randomized trial comparing a high-loading dose regimen with standard dosing (AmBiLoad trial).,” Clin. Infect. Dis. an Off. Publ. Infect. Dis. Soc. Am., vol. 44, no. 10, pp. 1289–1297, May 2007, doi: 10.1086/514341.
[13] E. J. Ernst, M. E. Klepser, and M. A. Pfaller, “Postantifungal effects of echinocandin, azole, and polyene antifungal agents against Candida albicans and Cryptococcus neoformans,” Antimicrob. Agents Chemother., vol. 44, no. 4, pp. 1108–1111, 2000, doi: 10.1128/AAC.44.4.1108-1111.2000.
[14] N. Robbins, G. D. Wright, and L. E. Cowen, “Antifungal drugs: The current armamentarium and development of new agents,” The Fungal Kingdom, no. 1, pp. 903–922, 2017, doi: 10.1128/9781555819583.ch44.
[15] J. E. Nett and D. R. Andes, “Antifungal Agents: Spectrum of Activity, Pharmacology, and Clinical Indications,” Infect. Dis. Clin. North Am., vol. 30, no. 1, pp. 51–83, 2016, doi: 10.1016/j.idc.2015.10.012.
[16] L. Scorzoni et al., “Antifungal therapy: New advances in the understanding and treatment of mycosis,” Front. Microbiol., vol. 8, no. JAN, pp. 1–23, 2017, doi: 10.3389/fmicb.2017.00036.
[17] D. Andes and M. van Ogtrop, “Characterization and quantitation of the pharmacodynamics of fluconazole in a neutropenic murine disseminated candidiasis infection model.,” Antimicrob. Agents Chemother., vol. 43, no. 9, pp. 2116–2120, Sep. 1999, doi: 10.1128/AAC.43.9.2116.
[18] D. Andes, K. Marchillo, T. Stamstad, and R. Conklin, “In vivo pharmacokinetics and pharmacodynamics of a new triazole, voriconazole, in a murine candidiasis model,” Antimicrob. Agents Chemother., vol. 47, no. 10, pp. 3165–3169, 2003, doi: 10.1128/AAC.47.10.3165-3169.2003.
[19] J. H. Rex et al., “Development of interpretive breakpoints for antifungal susceptibility testing: conceptual framework and analysis of in vitro-in vivo correlation data for fluconazole, itraconazole, and candida infections. Subcommittee on Antifungal Susceptibility Testing of the National Committee for Clinical Laboratory Standards.,” Clin. Infect. Dis. an Off. Publ. Infect. Dis. Soc. Am., vol. 24, no. 2, pp. 235–247, Feb. 1997, doi: 10.1093/clinids/24.2.235.
[20] A. J. Lepak, K. Marchillo, J. VanHecker, D. Diekema, and D. R. Andes, “Isavuconazole pharmacodynamic target determination for Candida species in an in vivo murine disseminated candidiasis model.,” Antimicrob. Agents Chemother., vol. 57, no. 11, pp. 5642–5648, Nov. 2013, doi: 10.1128/AAC.01354-13.
[21] D. Andes and M. Van Ogtrop, “Characterization and quantitation of the pharmacodynamics of fluconazole in a neutropenic murine disseminated candidiasis infection model,” Antimicrob. Agents Chemother., vol. 43, no. 9, pp. 2116–2120, 1999, doi: 10.1128/aac.43.9.2116.
[22] P. F. Troke, H. P. Hockey, and W. W. Hope, “Observational study of the clinical efficacy of voriconazole and its relationship to plasma concentrations in patients.,” Antimicrob. Agents Chemother., vol. 55, no. 10, pp. 4782–4788, Oct. 2011, doi: 10.1128/AAC.01083-10.
[23] A. Sudan et al., “Pharmacokinetics and pharmacodynamics of fluconazole for cryptococcal meningoencephalitis: Implications for antifungal therapy and in Vitro susceptibility breakpoints,” Antimicrob. Agents Chemother., vol. 57, no. 6, pp. 2793–2800, 2013, doi: 10.1128/AAC.00216-13.
[24] D. Andes, K. Marchillo, T. Stamstad, and R. Conklin, “In Vivo Pharmacodynamics of HMR 3270, a Glucan Synthase Inhibitor, in a Murine Candidiasis Model,” Antimicrob. Agents Chemother., vol. 47, no. 4, pp. 1193–1199, 2003, doi: 10.1128/AAC.47.4.1193-1199.2003.
[25] K. V. Clemons, M. Espiritu, R. Parmar, and D. A. Stevens, “Assessment of the paradoxical effect of caspofungin in therapy of candidiasis,” Antimicrob. Agents Chemother., vol. 50, no. 4, pp. 1293–1297, 2006, doi: 10.1128/AAC.50.4.1293-1297.2006.